
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
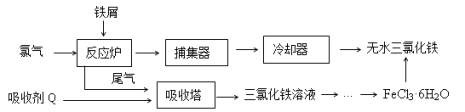
(1)由FeCl3· 6H2O晶体制备无水FeCl3应采取的措施是: 。
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000mol·L-1Na2S2O3溶液滴定用去12.50mL。
已知:I2+2S2O32-=2I-+S4O62-
① 写出加入稍过量的KI溶液反应的离子方程式: 。
② 求样品中氯化铁的质量分数(写出计算过程)。
【答案】
(1)在通HCl气体的氛围下加热。
(2)蒸发浓缩;冷却结晶;
(3)2.6×10-9mol·L-1;
(4)①2Fe3++2I-=2Fe2++I2;
②氯化铁的质量分数88.32%。
【解析】
试题分析:(1)FeCl3水解生成的氯化氢易挥发,制备无水FeCl3应在通HCl气体的氛围下加热,故答案为:在通HCl气体的氛围下加热;
(2)由表中数据可知,温度越高氯化铁的溶解度越高,由溶液获得晶体需加热蒸发、冷却晶体.Fe3+易水解应先加入少量的盐酸,抑制Fe3+水解,再热蒸发、冷却晶体获得FeCl36H2O,故答案为:加热浓缩;再冷却结晶;
(3)当溶液pH为4时,溶液中c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=2.6×10-39,所以溶液中c(Fe3+)=![]() =2.6×10-9 molL-1,故答案为:2.6×10-9 molL-1;
=2.6×10-9 molL-1,故答案为:2.6×10-9 molL-1;
(4)10ml水样中存在的反应有:2Fe3++2I-=2Fe2++I2,I2+2S2O32-=2I-+S4O62-,n(FeCl3)=2n(I2)= n(Na2S2O3) =12.50mL ×10-3L·mL-1 ×0.1000 mol·L-1=1.25×10-3mol,氯化铁的质量分数= 162.5g.mol-1 ×1.25×10-3mol ×10l/2.300g ×100%=88.32%,故答案为:88.32%。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
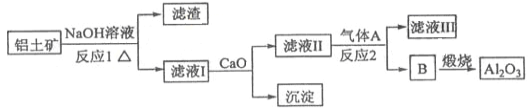
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
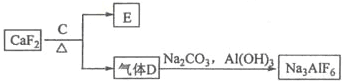
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
回答下列问题:
(1)写出反应1的化学方程式__________________________;
(2)滤液Ⅰ中加入CaO生成的沉淀是____________,反应2的离子方程式为____________________;
(3)E可作为建筑材料,化合物C是__________,写出由D制备冰晶石的化学方程式____________;
(4)电解制铝的化学方程式是__________________,以石墨为电极,阳极产生的混合气体的成分是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
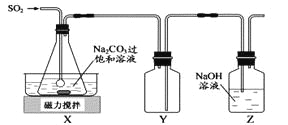
当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为2NaHSO3=2Na2S2O5+H2O。
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为 。
(2)装置Y的作用是 。
(3)析出固体的反应液经减压抽滤,洗涤,25℃-30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、 和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe3+的基态核外电子排布式 。
(2)HCHO分子中碳原子轨道的杂化轨道类型为 ;1mol HCN分子中含有σ键的数目为__________mol。
(3)N2O的空间构型为 ,与N2O互分等电子体的一种离子为 。
(4)TiO2的天然晶体中,最稳定的一种晶体结构如下图,则黑球表示 原子。
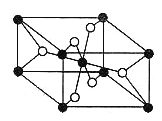
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的氧化产物是甲,还原产物是乙,甲和乙都能与钠反应放出H2,甲和乙反应生成丙,甲和丙都能发生银镜反应。该有机物是
A. 甲醛 B. 乙醛 C. 甲酸 D. 甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙烯和乙醇均能被酸性高锰酸钾溶液氧化
B. 甲烷和苯均可在光照的条件下与氯气发生取代反应
C. 分子式为C2H6O的有机物均可在一定条件下与乙酸发生酯化反应
D. 蛋白质、油脂、葡萄糖均可在一定条件下发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:I->Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为( )
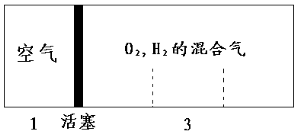
A.0.12 mol·L-1 B.0.1 mol·L-1 C.1.2 mol·L-1 D.1.0 mol·L-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,属于弱电解质的是(填序号,下同) ,属于非电解质是 。
①硫酸氢钠固体 ②次氯酸钠 ③氯化氢气体 ④蔗糖 ⑤硫酸钡 ⑥氨气 ⑦冰醋酸
(2)写出下列物质在水中的电离方程式:碳酸: 。次氯酸钠: 。
(3)甲、乙两瓶氨水的浓度分别为1 molL-1、0.1 molL-1,则c(OH﹣)甲:c(OH﹣)乙 10(填“大于”、“等于”或“小于”)。
(4)现有常温条件下甲、乙、丙三种溶液,甲为0.1 molL-1的NaOH溶液,乙为0.1 molL-1的HCl溶液,丙为0.1 molL-1的CH3COOH溶液,甲、乙、丙三种溶液中由水电离出的c(OH﹣)的大小关系为 。
(5)NO2与NO之间存在如下可逆反应:2NO2![]() 2NO+O2。T oC时,在一恒容密闭容器中充入适量NO2,反应达到平衡状态的标志是 。(填序号)
2NO+O2。T oC时,在一恒容密闭容器中充入适量NO2,反应达到平衡状态的标志是 。(填序号)
①混合气体的颜色不再改变的状态
②混合气体的密度不再改变的状态
③混合气体的压强不再改变的状态
④混合气体的平均相对分子质量不再改变的状态
⑤![]() 的比值不再改变的状态
的比值不再改变的状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com