
【题目】25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如图所示(已知Ksp(AgCl)=1.8×10—10),下列说法正确的是
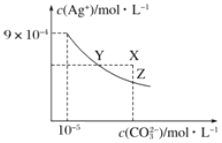
A.根据图示可计算出Ksp(Ag2CO3)=9×10—9
B.向Ag2CO3饱和溶液中加入K2CO3饱和溶液,可以使Y点移到X点
C.反应Ag2CO3(s)+2Cl—(aq)![]() 2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108
2AgCl(s)+CO32—(aq)的化学平衡常数K=2.5×108
D.将0.001mol/LAgNO3溶液滴入浓度均为0.001mol/L的KCl和K2CO3的混合溶液,CO32—先沉淀
【答案】C
【解析】
A.Ag2CO3的溶度积常数为Ksp(Ag2CO3)=c2(Ag+)c(CO32-),根据图象提供的数据计算;
B.图象上Y点表示离子积Qc=Ksp,达到沉淀溶解平衡,X点的含义为离子积Qc>Ksp,反应向生成沉淀的方向进行,据此分析;
C.反应Ag2CO3(s)+2Cl-(aq)2AgCl(s)+CO32-(aq),根据多重平衡规则计算该反应的平衡常数K;
D.在0.001mol/LAgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,根据AgCl和Ag2CO3的Ksp计算二者形成沉淀分别需要的Cl-和CO32-的浓度,据此判断产生沉淀的顺序。
A.Ag2CO3的溶度积常数为Ksp(Ag2CO3)=c2(Ag+)c(CO32-),根据图象,c(Ag+)=9×10-4mol/L,c(CO32-)=10-5mol/L,则Ksp(Ag2CO3)=c2(Ag+)c(CO32-)=(9×10-4)2×10-5=8.1×10-12,故A错误;
B.图象上Y点表示离子积Qc=Ksp,达到沉淀溶解平衡,X点的含义为离子积Qc>Ksp,反应向生成沉淀的方向进行,向Ag2CO3饱和溶液中加入K2CO3饱和溶液,增大了溶液中CO32-的浓度,使得沉淀溶解平衡向生成沉淀的方向进行,溶液中c(Ag+)的浓度减小,不可以使Y点移到X点,故B错误;
C.反应Ag2CO3(s)+2Cl-(aq)2AgCl(s)+CO32-(aq),化学平衡常数为K=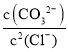 =
=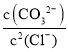 ×
×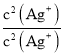 =
=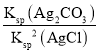 =
=![]() =2.5×108,故C正确;
=2.5×108,故C正确;
D.在0.001mol/LAgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,产生AgCl沉淀需要的Cl-的浓度为c(Cl-)=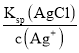 =
=![]() =1.8×10-7mol/L,产生Ag2CO3沉淀需要CO32-的浓度为c(CO32-)=
=1.8×10-7mol/L,产生Ag2CO3沉淀需要CO32-的浓度为c(CO32-)=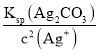 =
=![]() =8.1×10-6mol/L,因此产生AgCl沉淀所需要的Cl-浓度更小,则优先产生AgCl沉淀,故D错误;
=8.1×10-6mol/L,因此产生AgCl沉淀所需要的Cl-浓度更小,则优先产生AgCl沉淀,故D错误;
故选C。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室需配制0.10 mol·L-1 NaCl溶液250 mL。
(1)容量瓶上需要标有_________。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸(碱)式
(2)按下列操作步骤填上适当的文字,以使整个操作完整。
第一步:选择仪器。完成本实验所必需的仪器有:
天平(精确到0.1 g)、药匙、_____、_____、_____、_____以及等质量的两片纸。
第二步:计算。配制该溶液需取NaCl晶体______g。
第三步:称量。
①天平调平之后,应将天平的游标调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:______
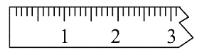
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入________中。
第四步:__________,该步实验中还需进行的动手操作是: _________________________________
第五步:转移、洗涤。
第六步:_____________________________________。
第七步: ____________________________________。
第八步:将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、名称及浓度。
(3)定容摇匀后,某同学发现液面略低于刻度线,又用蒸馏水添加至刻度线。该操作是否会对所配制的溶液浓度造成影响?为什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:①H2 ②铝 ③Na2O2 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
分类标准 | 能导电 | 非电解质 | 电解质 |
属于该类的物质 | ___ | ___ | ___ |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___。
(3)过量的⑦滴加到⑨的溶液中的离子方程式为___,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为___。
(4)④与③充分反应的化学方程式为:___,当转移NA电子,生成标况下气体的体积为___。
(5)②与⑧发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,该反应的氧化剂是___(填化学式),还原剂与氧化剂的物质的量之比是___,当有5.4gAl发生反应时,转移电子的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A.将混合气体中的氨液化有利于合成氨反应
B.对CO(g)+NO2(g)![]() CO2(g)+NO(g)平衡体系增大压强可使其颜色变深
CO2(g)+NO(g)平衡体系增大压强可使其颜色变深
C.常温下,将1mLpH=3的醋酸溶液加水稀释到100mL,测得其pH<5
D.实验室中常用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁(FeC2O4)可作为生产电池正极材料磷酸铁锂的原料,受热容易分解,为探究草酸亚铁的热分解产物,按下面所示装置进行实验。
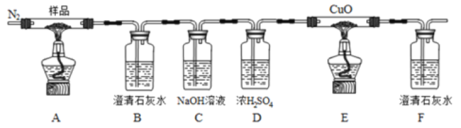
下列说法不正确的是
A.实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO
B.反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C.装置C的作用是除去混合气中的CO2
D.反应结束后,应熄灭A,E处酒精灯后,持续通入N2直至温度恢复至室温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若以NA代表阿伏加德罗常数的值,下列说法中正确的是
A.20g NaOH溶于1L水,可配得0.5mol/LNaOH溶液
B.100mL 0.1mol/L硫酸溶液中含有的氧原子数约为0.04NA
C.5 mL 0.3 mol/L Na2SO4溶液和5 mL 0.3 mol/L NaNO3溶液Na+ 物质的量浓度相等
D.a g C2H4和C3H6的混合物所含碳原子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同;基态b原子的核外电子占据3个能级,且最高能级轨道为半充满状态;c的最外层电子数是内层电子数的3倍;d的原子序数是c的两倍;基态e原子3d轨道上有4个单电子。
回答下列问题:
(1)b、c、d电负性最大的是___(填元素符号)。
(2)b单质分子中σ键与π键的个数比为___。
(3)a与c可形成两种二元化合物分子,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中的c原子的杂化方式为___;这两种物质的互溶物中,存在的化学键有___(填序号)。
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸中,分子内中心原子的价层电子对数为4的酸是___(填化学式,下同);酸根呈正三角形结构的酸是___,试从两者结构特点判断该酸分子与酸根离子的稳定性:酸分子___酸根离子(填“>”或“<”)。
(5)元素e在周期表中的位置是___区;e的一种常见氯化物中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,结构式为![]() ,请补写e的元素符号并用“→”表示出其中的配位键___。
,请补写e的元素符号并用“→”表示出其中的配位键___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列问题:
(1)写出由乙醇制取乙二酸的反应方程式_________。
(2)相对分子质量为72且沸点最低的烷烃的习惯名称是__________。
(3)用系统命名法命名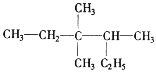 _____。
_____。
(4)某烯烃分子式为C6H12,其同分异构体中主链为4个碳原子的有______种。
(5)合成高聚物![]() 其单体的键线式_______。
其单体的键线式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究 CO2的利用对促进低碳社会的构建具有重要意义。
(1)一定条件下,在 CO2 与足量碳反应所得平衡体系中加入 H2 和适当催化剂,有下列反应发生:CO(g)+3H2(g) ![]() CH4(g)+H2O(g) H1=-206.2kJ/mol ;CO(g)+H2O(g)
CH4(g)+H2O(g) H1=-206.2kJ/mol ;CO(g)+H2O(g)![]() CO2(g)+H2(g)H2若 CO2 和 H2 反应生成 0.1mol CH4(g)和一定量的 H2O(g), 整个过程中放出的热量为 16.5kJ, 则△H2=__________。
CO2(g)+H2(g)H2若 CO2 和 H2 反应生成 0.1mol CH4(g)和一定量的 H2O(g), 整个过程中放出的热量为 16.5kJ, 则△H2=__________。
(2)为研究 CO2 与 CO 之间的转化。让一定量的 CO2 与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H。 测得压强、温度对 CO 的体积分数(φ(CO)%)的影响如图所示:
2CO(g) H。 测得压强、温度对 CO 的体积分数(φ(CO)%)的影响如图所示:
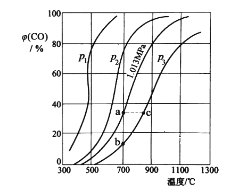
回答下列问题:
① p1、p2、p3 的大小关系是__________,图中 a、b、c 三点对应的平衡常数大小关系是__________(用 Ka、Kb、Kc 表示)。
② 900 ℃、1.013 MPa 时,1 mol CO2 与足量碳反应达平衡后容器的体积为VL,CO2 的转化率为__________,(保留一位小数)该反应的平衡常数 K=__________。
③将②中平衡体系温度降至 640 ℃,压强降至 0.1013 MPa,重新达到平衡后 CO2 的体积分数为 50%。条件改变时,正反应和逆反应速率如何变化?__________,二者之间有何关系?__________。
(3)CO2 可用于工业制备草酸锌,其原理如下图所示(电解液不参加反应),Zn 电极是__________极。已知在 Pb 电极区得到 ZnC2O4,则 Pb 电极上的电极反应式为__________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com