
【题目】下列分子中,所有原子都满足最外层8电子结构的是
A. N2 B. HClO C. PCl3 D. BF3
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,向10mL bmol·L-1的CH3COOH溶液中滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(Na+)=c(CH3COO-), 下列说法正确的是( )
A. b<0.01
B. 混合后溶液呈碱性
C. 常温下,所得溶液中CH3COOH的的电离常数Ka=![]() mol·L-1
mol·L-1
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学选修3—有机化学基础)
8羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8羟基喹啉的合成路线。
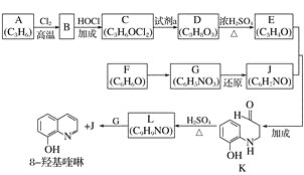
已知:ⅰ.![]()
ⅱ.同一个碳原子上连有2个羟基的分子不稳定。
(1)按官能团分类,A的类别是________________。
(2)A→B的化学方程式是________________。
(3)C可能的结构简式是________________。
(4)C→D所需的试剂a是________________。
(5)D→E的化学方程式是________________。
(6)F→G的反应类型是________________。
(7)将下列K→L的流程图补充完整:
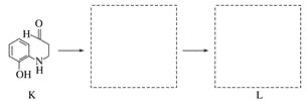 ___________________________
___________________________
(8)合成8羟基喹啉时,L发生了________(填“氧化”或“还原”)反应。反应时还生成了水,则L与G物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化镁用于制药工业,还是重要的绿色阻燃剂。
I、治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2。
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式:___________。
Ⅱ、已知:Mg (s)+2H2O(g)=Mg(OH)2(s)+H2(g) △H1=-441kJ·mol-1
H2O(g)=H2(g)+![]() O2(g) △H2=+242kJ·mol-1
O2(g) △H2=+242kJ·mol-1
Mg(s)+![]() O2(g)=MgO(s) △H3=-602kJ·mol-1
O2(g)=MgO(s) △H3=-602kJ·mol-1
(2)氢氧化镁分解的热化学方程式是___________。
(3)氢氧化镁可以作为阻燃剂的原因_________。(写一条即可)
Ⅲ、某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。
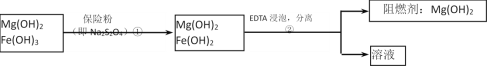
(4)步骤②中分离操作的名称是__________。
(5)步骤①中的反应如下:6Fe(OH)3 +S2O42-+2OH- =6Fe(OH)2 +2SO42-+4H2O。每消耗0.1mol保险粉(Na2S2O4)时,转移电子的数目是__________mol。
(6)已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(OH)2反应。虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2。请从沉淀溶解平衡的角度加以解释。
_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液存在水解平衡:S2+H2O![]() HS+OH。下列说法正确的是( )
HS+OH。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 升高温度,c(HS)/c(S2)增大
C. 加入NaOH固体,溶液pH减小
D. 通入CuSO4固体,HS浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁是合成草酸铁的重要原料。
利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:

(1)抑制FeCl3水解,溶液X为___________。
(2)流程中FeCl3能被异丙醚萃取,其原因是__________________________;检验萃取、分液后所得水层中是否含有Fe3+的方法是_______________________________________。
(3)得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是________________________。
(4)为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于下图所示仪器_____(填“甲”或“乙”)中。
![]()
下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是_____________。
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫;而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置已略去):
试回答:
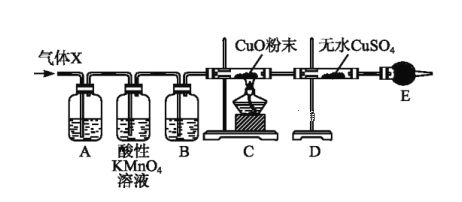
(1)上述实验中生成二氧化硫气体的化学方程式为_________。
(2)乙同学认为还可能产生氢气的理由是__________。
(3)丙同学在安装好装置后,必不可少的一步操作是__________。
(4)B中加入的试剂是______,其作用是___________。
(5)可以证明气体X中含有氢气的实验现象是;C中______,D中______。如果撤去装置B,是否还能根据D中的现象判断气体X中含有氢气?___________
为什么?_______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B ![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A. v(A)=0.5mol·L-1· s-1B. v(B)=0.3 mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1D. v(D)=10 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验内容、实验装置和对应的实验目的均正确的是
A. 测定中和热 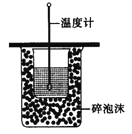
B. 比较Cu2+、Fe3+对反应速率的影响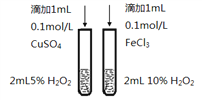
C. 比较醋酸和硼酸的酸性强弱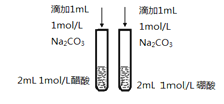
D. 比较温度对化学反应速率的影响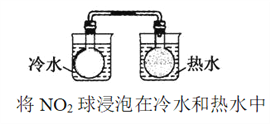
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com