
【题目】三氯化铁是合成草酸铁的重要原料。
利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:

(1)抑制FeCl3水解,溶液X为___________。
(2)流程中FeCl3能被异丙醚萃取,其原因是__________________________;检验萃取、分液后所得水层中是否含有Fe3+的方法是_______________________________________。
(3)得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是________________________。
(4)为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于下图所示仪器_____(填“甲”或“乙”)中。
![]()
下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是_____________。
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
【答案】(浓)盐酸 FeCl3在异丙醚中的溶解度大于其在水中的溶解度 取少量溶液,向其中滴加少量KSCN溶液,若溶液变红,则含有Fe3+(或其他合理方法) 除去杂质、减少草酸铁晶体的溶解损耗 甲 c
【解析】
利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)35H2O]的实验流程:工业FeCl3用盐酸溶解,抑制铁离子的水解,FeCl3在异丙醚中的溶解度大于其在水中的溶解度,用异丙醚萃取FeCl3,继续向分液漏斗中加入适量异丙醚,充分振荡、静止,弃去水溶液,异丙醚溶液中加入草酸(H2C2O4)溶液,充分反应后分液,弃去醚层,水溶液通过蒸发、结晶、过滤、洗涤、干燥,得到草酸铁晶体[Fe2(C2O4)35H2O]。
①Fe3+易水解,水解生成H+,水解的离子方程式为Fe3++3H2OFe(OH)3+3H+,FeCl3溶液用盐酸酸化,不引入杂质,且抑制铁离子的水解,
故答案为:(浓)盐酸;
②萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度;检验Fe3+时可以选用KSCN溶液,
故答案为:FeCl3在异丙醚中的溶解度大于其在水中的溶解度;取少量溶液,向其中滴加少量KSCN溶液,若溶液变红,则含有Fe3+;
③洗涤是除去沉淀表面杂质,用冰水洗涤可以减少沉淀溶解损失,
故答案为:除去杂质、减少草酸铁晶体的溶解损耗;
④KMnO4标准溶液具有强氧化性,能氧化腐蚀碱式滴定管中的橡胶,应置于酸式滴定管中;
a.没有润洗导致高锰酸钾浓度低消耗的体积多,结果偏高;
b.滴定管滴定前尖嘴部分有气泡,滴定后消失,读取高锰酸钾溶液体积多,结果偏高;
c.滴定前仰视读数,滴定后俯视读数,高锰酸钾溶液体积读数偏小,结果偏低,正确;
故答案为:甲;c.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的是( )

A. 甲为小苏打,乙为纯碱
B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯的澄清石灰水变浑浊
D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图有关图示分析正确的是( )
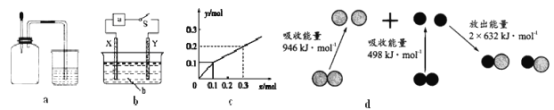
A. 如图a所示,集气瓶内充満Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,焼杯中的水会迸入集气瓶,并可能充满集气瓶
B. 如图b所示,X为铁棒,Y为铜棒,M为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入M
C. Pt内电极, 电解含0.10 mol M+和0.1 molN3+ (M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+
D. 图d为N2(g)和O2(g)生成NO(g)过程中的能量変化,则N-N的键能为946kJ·mol-1,其热化学方程式为N2(g)+O2(g)=2NO(g) △H=-180 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 元素周期表中,除第一和第七周期外,第n周期所含非金属元素(包括稀有气体元素)的种数均为(8-n)
B. SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构
C. M层电子数为奇数的主族元素所在族的序数与该元素原子的M层电子数不一定相等
D. 由ⅠA族和ⅥA族短周期元素形成的原子个数比为1∶1,电子总数为38的化合物,是含有共价键的离子型化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH 溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知 2C(s)+O2(g)=2CO(g)△H= -221 kJ·mol-1, 则可知 C 的热值为 110.5 kJ·mol1
C. 0℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ, 其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= -38.6kJ·mol1
2NH3(g) △H= -38.6kJ·mol1
D. 密闭容器中,0.3mol 硫粉与 0.2mol 铁粉混合加热生成硫化亚铁 0.2mol 时,放出 19.12 kJ 热量, 则 Fe(s)+S(s)=FeS(s)△H= - 95.6 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示。该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液。下列关于该电池的叙述正确的是
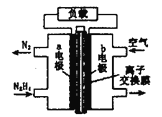
A. b极发生氧化反应
B. a极的反应式为N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电子从a极经过负载流向b极,再经溶液流回a极
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知反应:2A(l) ![]() B(l) △H=-QkJ/mol,取等量A分别在0℃和20 ℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是
B(l) △H=-QkJ/mol,取等量A分别在0℃和20 ℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是
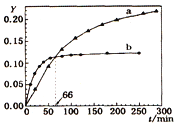
A. a代表20℃下A的Y-t曲线
B. 反应到66min时,0℃和20℃下反应放出的热量相等
C. 0℃和20℃下达到平衡时,反应都放出QkJ热量
D. 反应都达到平衡后,正反应速率a > b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。CaO2和Na2O2在结构和性质上有很多相似的地方。请完成下列问题:
(1)CaO2属于____(填“离子化合物”或“共价化合物”),其电子式为_____,其阴、阳离子个数比为______。
(2)CaO2与水反应的化学方程式为______,生成1mol单质气体,转移的电子数为__________。(用NA代表阿伏加德罗常数)
(3)CaO2与二氧化碳反应的化学方程式为_________,该反应属于____________。
A.置换反应 B.氧化还原反应 C.复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com