
【题目】某固体化合物A,按图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
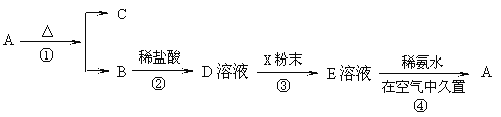
回答下列问题:(1)物质A是___(填化学式)。
(2)反应②的离子反应方程式为___。
(3)反应④的化学反应方程式为___。
【答案】Fe(OH)3 Fe2O3+6H+=2Fe3++3H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液,据此分析。
已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色说明A为氢氧化铁,Fe(OH)3,A加热分解生成B为Fe2O3,C为H2O,依据流程分析判断D为FeCl3,X为Fe,E为FeCl2 溶液。
(1)依据推断可知A为Fe(OH)3;
(2)反应②是盐酸和氧化铁发生的复分解反应,反应的离子反应方程式为Fe2O3+6H+=2Fe3++3H2O;
(3)反应④是氢氧化亚铁和氧气水 发生反应生成氢氧化铁的也还原反应,反应的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列实验方案与现象正确且能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案与现象 |
A | 证明新制氯水具有酸性 | 向新制氯水中滴加紫色石蕊试液,溶液变为红色且颜色保持不变 |
B | 证明酸性条件下,氧化性:H2O2 > Fe3 + | 向Fe(NO3)2溶液中滴加用硫酸酸化的H2O2溶液,溶液变黄色 |
C | 证明同温下,溶度积常数: Ksp(AgCl)> Ksp(Ag2CrO4) | 向体积为100 mL、浓度均为0.01 mol·L-1的NaCl和Na2CrO4混合溶液中滴加 0.01 mol·L-1AgNO3溶液,先产生白色沉淀,后产生砖红色沉淀Ag2CrO4 |
D | 证明溶液X中含有 | 向溶液X中先滴加盐酸无明显现象,再滴加BaCl2溶液,出现白色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气,其变化可表述为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl↑2+8H2O。
(1)请将上述化学方程式改写为离子方程式:__。
(2)浓盐酸在反应中显示出来的性质是__(填编号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(3)此反应中氧化产物是Cl2,若产生0.5molCl2,则转移电子的物质的量为__mol。
(4)用双线桥法表示该反应电子转移的方向和数目__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计下图装置进行电解饱和食盐水自制“84”消毒液。回答下列问题

(1)电解饱和食盐水时,a连接电源的_________极(填“正”或“负”)。
(2)利用该装置自制消毒液的化学反应方程式是_________。
(3)①“84”消毒液不用时需要密封保存,否则会与空气中_________发生反应,生成不稳定的物质。
②该同学利用传感技术进行某溶液中次氯酸的稳定性实验。用强光照射盛有该溶液的广口瓶,过程中溶液的pH、Cl-的浓度、瓶中氧气的体积分数变化如下图:
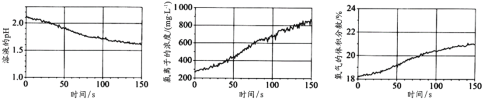
该同学分析数据得出的结论是_________(用化学方程式表示)。
(4)“84”消毒液不能与洁厕灵混用,也不能与消毒酒精混用,请从物质性质的角度解释“84”消毒液不能与消毒酒精混用的原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
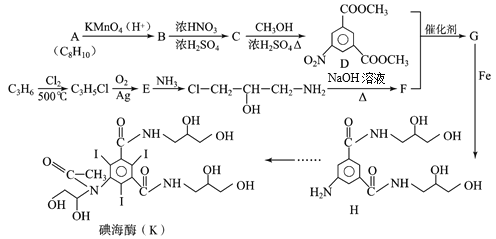
【题目】碘海醇是一种临床中应用广泛的非离子型造影剂,具有耐受性好,毒性低等优点,利用碘海醇做造影剂进行肺部CT检查,能为新冠肺炎确诊及治疗提供重要参考,碘海醇的一种合成路线如下:
已知:①![]()
②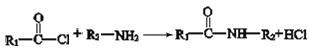
(1)已知A是苯的同系物,则A的结构简式为________。
(2)C中所含官能团的名称为_________。
(3)写出C→D的化学反应方程式_________。
(4)E的结构简式为_______。
(5)M与B互为同分异构体,M是含有苯环的酯类物质,能发生银镜反应,且苯环上一氯取代物有两种。写出任意一种符合上述条件的M的结构简式________。
(6)上述合成路线中,由合成碘海醇过程如下,下列说法正确的是________。
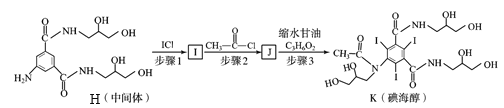
a. 步骤1中1 mol H需消耗3 mol ICl,并且有副产物HCl生成
b. 步骤2和步骤3中的反应类型相同
c. 碘海醇极易溶于水与其结构中存在较多的羟基有关
(7)有机物Q(C3H8O3)可由油脂水解制得,已知合成路线中的物质B可与Q形成交联聚合物P,P的结构片段如下:
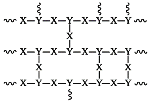
①其中![]() 的结构简式为_______。
的结构简式为_______。
②写出一定条件下相同物质的量的B与Q反应,形成线型高分子的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积两种一元酸“酸1”和“酸2”分别用等浓度的 KOH 溶液滴定,滴定曲线如图所示。下列说法错误的是
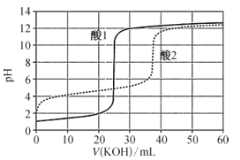
A.“酸1”比“酸2”的酸性强
B.“酸2”的浓度为0.01mo1L-1
C.“酸2”的Ka 的数量级约为10-5
D.滴定“酸1”和“酸2”均可用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含镍废硫酸盐(含 Ni2+ 、Fe2+ 、Cu2+ 、Co2+ 、A13+ 、Mn2+ 、Cr3+ 、Mg2+ 、Zn2+ 等)为原料制取NiSO4·6H2O 的工艺流程如下:
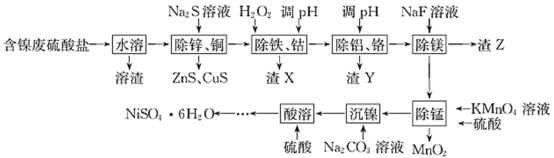
相关金属离子形成氢氧化物沉淀的pH 范围如下:
金属离子 | Co2+ | Co3+ | Fe2+ | Fe3+ | A13+ | Cr3+ | Ni2+ |
开始沉淀的pH | 7.2 | 0.23 | 6.3 | 1.5 | 4.1 | 4.3 | 6.9 |
沉淀完全的pH | 9.2 | 1.1 | 8.3 | 2.8 | 5.4 | 5.6 | 8.9 |
回答下列问题:
(1)已知1gKsp(CuS)= -47.6,1gKsp(ZnS)= -23.8,则反应ZnS+Cu2+![]() CuS+Zn2+的平衡常数对数值1gK= ________________________。
CuS+Zn2+的平衡常数对数值1gK= ________________________。
(2)“除铁、钴”时,加入H2O2的目的是 ______________,得到的渣X为________。
(3) “除铝、铬”时,调pH 范围为 _________;滤渣Y 中含Cr(OH)3,其性质与 A1(OH)3 类似,写出Cr(OH)3与NaOH反应的化学方程式: __________________。
(4)“除锰”时,发生反应的离子方程式为___________________________。
(5)“酸溶”得到溶液制备 NiSO4·6H2O晶体,还需进行的操作工艺是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是
A. 0.01mol·L﹣1NH4Al(SO4)2溶液与0.02mol·L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3·H2O
B. 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ·mol﹣1
2NH3(g)△H=﹣38.6kJ·mol﹣1
C. H2(g)+![]() O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,则H2的燃烧热为285.8 kJ·mol﹣1
O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,则H2的燃烧热为285.8 kJ·mol﹣1
D. CO(g)的燃烧热是283.0 kJ·mol﹣1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ·mol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com