
【题目】等体积两种一元酸“酸1”和“酸2”分别用等浓度的 KOH 溶液滴定,滴定曲线如图所示。下列说法错误的是
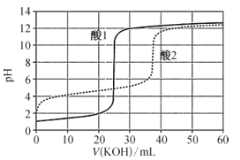
A.“酸1”比“酸2”的酸性强
B.“酸2”的浓度为0.01mo1L-1
C.“酸2”的Ka 的数量级约为10-5
D.滴定“酸1”和“酸2”均可用酚酞作指示剂
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 人们最早先根据味道来获得朴素的酸、碱概念:一切有酸味的物质都是酸,一切有涩味的物质都是碱。
B. 波义耳基于指示剂变色来分辨酸碱:酸一定能使石蕊变红,碱一定能使石蕊变蓝。
C. 地球上最大规模的化学反应是植物的光合作用,人类利用氮肥的最有效的反应是合成氨反应。
D. 酸碱质子理论:凡是能给出![]() 的物质就是酸,凡是能结合
的物质就是酸,凡是能结合![]() 的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化。其中A为金属试回答:

(1)写出B的化学式________________,D的化学式________________。
(2)写出由D转变成H的化学方程式________________。
(3)写出向G溶液加入A的有关离子反应方程式________________。
(4)写出E转变为F的实验现象为:_________________________化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组通过下列步骤测定某工厂废液中铜离子的浓度(已知废水中Fe3+对测定有干扰作用)。
i. 经检验废液中含有Fe3+离子,取V1 mL上述废液,加入NH4HF2,再加H2SO4酸化至pH<4,再次检测,未检验出Fe3+离子;
ii. 在上述溶液中,加入过量KI溶液,放置3 min,有沉淀CuI生成,立即用0.1000 mol/LNa2S2O3标准溶液滴定至浅黄色,加3 mL淀粉指示剂,继续滴定,至溶液变为浅蓝色;
iii. 再向上述溶液中加入10% KSCN溶液10 mL,继续滴定至终点,共消耗Na2S2O3溶液V2 mL。
已知:①CuI、CuSCN均为白色难溶物,CuI能吸附少量I2,CuSCN不吸附I2。
②I2在水溶液中溶解度较小,I-+I2![]() I3-、I-、I2、I3-的平衡体系溶液呈黄色
I3-、I-、I2、I3-的平衡体系溶液呈黄色
③I2+2S2O32-=2I-+S4O62-,S2O32-和S4O62-无色;
(1)①步骤i中检验含Fe3+离子操作和现象_______。
②已知 Fe3++6F-![]() [FeF6]3-,如果省略步骤i,则导致实验结果________(填“偏大”或 “偏小” ) 。
[FeF6]3-,如果省略步骤i,则导致实验结果________(填“偏大”或 “偏小” ) 。
(2)①步骤ii中生成沉淀的离子方程式_____________。
②步骤ii中加入的KI的量是理论值的2至3倍,其目的一是使Cu2+充分反应;二是__________。
(3)①步骤iii中加入KSCN溶液使ii中的沉淀转化为CuSCN沉淀,其目的是___________。
②步骤iii中判定滴定终点的现象是_____________。
(4)经小组测定,废液中c(Cu2+)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体化合物A,按图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。
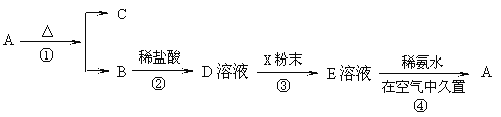
回答下列问题:(1)物质A是___(填化学式)。
(2)反应②的离子反应方程式为___。
(3)反应④的化学反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于摩尔质量的描述或应用中正确的是
A. 一个钠原子的质量等于![]() g B. 二氧化碳的摩尔质量是44 g
g B. 二氧化碳的摩尔质量是44 g
C. 铁原子的摩尔质量等于它的相对原子质量 D. 1 mol氢氧根离子的质量是17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 和 W 代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z 与 Y、W 均相邻;②X、Y、W 分别位于不同周期;③Y、Z、W 三种元素的原子最外层电子数之和为 17。下列说法正确的是
A.四种元素非金属性从弱到强的顺序为:X<W<Z<Y
B.四种元素的原子半径由小到大的顺序为:r(X)<r(Y)<r(Z)<r(W)
C.X 与其余三种元素之间形成的核外电子总数为 10 的微粒只有 4 种
D.X、Y、Z 既能形成离子化合物,又能形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的铜与100 mL一定物质的量浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液中加入100mL 6 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度是( )
A.6mol/LB.10mol/LC.11mol/LD.12 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com