
【题目】化学小组通过下列步骤测定某工厂废液中铜离子的浓度(已知废水中Fe3+对测定有干扰作用)。
i. 经检验废液中含有Fe3+离子,取V1 mL上述废液,加入NH4HF2,再加H2SO4酸化至pH<4,再次检测,未检验出Fe3+离子;
ii. 在上述溶液中,加入过量KI溶液,放置3 min,有沉淀CuI生成,立即用0.1000 mol/LNa2S2O3标准溶液滴定至浅黄色,加3 mL淀粉指示剂,继续滴定,至溶液变为浅蓝色;
iii. 再向上述溶液中加入10% KSCN溶液10 mL,继续滴定至终点,共消耗Na2S2O3溶液V2 mL。
已知:①CuI、CuSCN均为白色难溶物,CuI能吸附少量I2,CuSCN不吸附I2。
②I2在水溶液中溶解度较小,I-+I2![]() I3-、I-、I2、I3-的平衡体系溶液呈黄色
I3-、I-、I2、I3-的平衡体系溶液呈黄色
③I2+2S2O32-=2I-+S4O62-,S2O32-和S4O62-无色;
(1)①步骤i中检验含Fe3+离子操作和现象_______。
②已知 Fe3++6F-![]() [FeF6]3-,如果省略步骤i,则导致实验结果________(填“偏大”或 “偏小” ) 。
[FeF6]3-,如果省略步骤i,则导致实验结果________(填“偏大”或 “偏小” ) 。
(2)①步骤ii中生成沉淀的离子方程式_____________。
②步骤ii中加入的KI的量是理论值的2至3倍,其目的一是使Cu2+充分反应;二是__________。
(3)①步骤iii中加入KSCN溶液使ii中的沉淀转化为CuSCN沉淀,其目的是___________。
②步骤iii中判定滴定终点的现象是_____________。
(4)经小组测定,废液中c(Cu2+)=______________。
【答案】从废液中取出少许放入试管中,滴加几滴KSCN溶液,溶液显红色,证明溶液中含有Fe3+ 偏大 2Cu2++ 4I-=2CuI+ I2或2Cu2++5I-=2CuI+ I3- 使 I2转化成易溶于水的I3- 释放CuI沉淀吸附的少量I2 溶液由浅蓝色恰好变成无色,且半分钟不变色 ![]()
【解析】
(1)①根据Fe3+遇SCN-会使溶液变为血红色分析判断;
②根据Fe3++6F-![]() [FeF6]3-及Fe3+、Cu2+的氧化性分析,
[FeF6]3-及Fe3+、Cu2+的氧化性分析,
(2)①步骤ii中Cu2+与I-会发生氧化还原反应产生CuI和I2,反应产生的I2再结合I-形成I3-;
②根据反应产生的物质及其溶解性分析;
(3)①CuI、CuSCN均为白色难溶物,CuI能吸附少量I2,CuSCN不吸附I2。
②根据I2与淀粉溶液变为蓝色判断;
(4)根据反应转化关系,得到已知物质与待求物质之间的关系式,然后计算废液中c(Cu2+)。
(1)①从废液中取出少许放入试管中,滴加几滴KSCN溶液,若溶液显血红色,就可以证明溶液中含有Fe3+;
②在步骤i中加入NH4HF2,就可以发生反应Fe3++ 6F-![]() [FeF6]3-,消耗Fe3+,当加入过量KI溶液时,只发生反应2Cu2++4I-=2CuI+I2或2Cu2++ 5I-=2CuI+ I3-;否则还会发生反应:2Fe3++2I-=2Fe2++ I2,产生较多的I2,导致滴定时消耗较多的Na2S2O3标准溶液,使测定结果偏大;
[FeF6]3-,消耗Fe3+,当加入过量KI溶液时,只发生反应2Cu2++4I-=2CuI+I2或2Cu2++ 5I-=2CuI+ I3-;否则还会发生反应:2Fe3++2I-=2Fe2++ I2,产生较多的I2,导致滴定时消耗较多的Na2S2O3标准溶液,使测定结果偏大;
(2)①步骤ii中Cu2+与I-会发生氧化还原反应产生CuI和I2,反应方程式为:2Cu2++ 4I-=2CuI+I2或2Cu2++5I-=2CuI+ I3-;
②向含有Cu2+的溶液中加入KI溶液,发生反应:2Cu2++4I-=2CuI+I2,反应产生的I2在水中溶解度不大,但容易与溶液中的I-发生反应:I-+I2![]() I3-,所以步骤ii中加入的KI的量是理论值的2至3倍,其目的一是使Cu2+充分反应;二是使 I2转化成易溶于水的I3-;
I3-,所以步骤ii中加入的KI的量是理论值的2至3倍,其目的一是使Cu2+充分反应;二是使 I2转化成易溶于水的I3-;
(3)①步骤ii中加入KI溶液,反应产生CuI沉淀,同时产生I2,在步骤iii中加入KSCN溶液使ii中的CuI沉淀转化为CuSCN沉淀,利用CuI能吸附少量I2,CuSCN不吸附I2,因此该操作目的是释放CuI沉淀吸附的少量I2;
③溶液中Cu2+与I-反应产生I2,以淀粉为指示剂,此时溶液为蓝色,当不断滴加Na2S2O3标准溶液时,I2不断被消耗,当溶液中I2恰好反应完全时,溶液蓝色褪去,此时达到滴定终点,故步骤iii中判定滴定终点的现象是滴加最后一滴标准Na2S2O3溶液时,溶液由浅蓝色恰好变成无色,且半分钟不变色;
(4)根据反应方程式:2Cu2++4I-=2CuI+I2,I2+2S2O32-=2I-+S4O62-,可得关系式:2Cu2+~I2~2S2O32-,n(S2O32-)=c·V=0.1000 mol/L×V2×10-3 L=1.0×V2×10-4 mol,反应废液的体积是V1 mL= 1×10-3 L,根据关系式可知n(Cu2+)=n(S2O32-)=1.0×V2×10-4 mol,则反应后废液中c(Cu2+)=![]() =
=![]() mol/L。
mol/L。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室中用图1所示的装置进行氨气的喷泉实验,实验结束后的情况如图2所示,下列说法正确的是
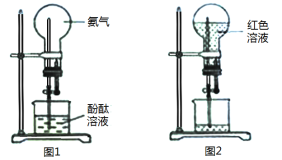
A.需要用热毛巾覆盖烧瓶底引发喷泉实验
B.红色溶液未充满是因为装置漏气
C.烧瓶中溶液呈红色是因为氨气能电离出OH-
D.若在标准状况下进行该实验,得到氨水的浓度是1/22.4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳固体氧化物电池是一种高效、环境友好的燃料电池。电池工作时,物质的转化原理如下图所示。下列说法正确的是
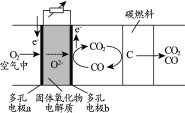
A.多孔电极a上,氧气发生氧化反应
B.多孔电极b的反应:CO-2e-+O2-=CO2
C.整个装置的总反应:CO2+C=2CO
D.该电池能将碳燃料产生的能量100%转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积固定的密闭容器中发生下列反应![]() ,在一定条件下已达平衡的事实是( )
,在一定条件下已达平衡的事实是( )
A. 容器内压强不变
B. 容器内A、B、C、D、E五者共存
C. A、D的消耗速率相等
D. D、C的生成速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计下图装置进行电解饱和食盐水自制“84”消毒液。回答下列问题

(1)电解饱和食盐水时,a连接电源的_________极(填“正”或“负”)。
(2)利用该装置自制消毒液的化学反应方程式是_________。
(3)①“84”消毒液不用时需要密封保存,否则会与空气中_________发生反应,生成不稳定的物质。
②该同学利用传感技术进行某溶液中次氯酸的稳定性实验。用强光照射盛有该溶液的广口瓶,过程中溶液的pH、Cl-的浓度、瓶中氧气的体积分数变化如下图:
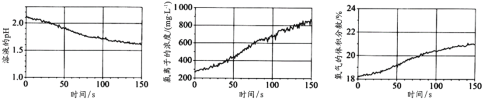
该同学分析数据得出的结论是_________(用化学方程式表示)。
(4)“84”消毒液不能与洁厕灵混用,也不能与消毒酒精混用,请从物质性质的角度解释“84”消毒液不能与消毒酒精混用的原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL碳酸钠与碳酸氢钠的混合溶液中,加入氢氧化钡溶液,生成的沉淀如表:
实验序号 | 1 | 2 | 3 |
V(氢氧化钡溶液)/mL | 80 | 160 | 240 |
沉淀质量/g | 1.576 | 3.152 | 3.940 |
将实验3的悬浊液过滤,在滤液中加![]() 盐酸,恰好呈中性。
盐酸,恰好呈中性。
(1)氢氧化钡溶液的物质的量浓度为___。
(2)若将原100mL碳酸钠与碳酸氢钠的混合溶液加热蒸干并灼烧至恒重,得到![]() ___g。
___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积两种一元酸“酸1”和“酸2”分别用等浓度的 KOH 溶液滴定,滴定曲线如图所示。下列说法错误的是
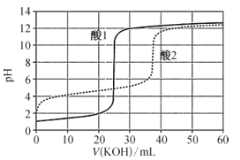
A.“酸1”比“酸2”的酸性强
B.“酸2”的浓度为0.01mo1L-1
C.“酸2”的Ka 的数量级约为10-5
D.滴定“酸1”和“酸2”均可用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置。电极Ⅰ为Al,其他电极均为Cu,则下列说法正确的是
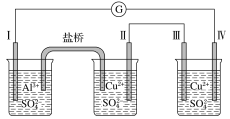
A. 电流方向:电极Ⅳ→![]() →电极Ⅰ
→电极Ⅰ
B. 电极Ⅰ发生还原反应
C. 电极Ⅱ逐渐溶解
D. 电极Ⅲ的电极反应:Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.白色无机盐 X(含三种元素,相对分子质量小于 400)能与水发生反应。为了探究 X 的组成,设计并完成了以下实验:
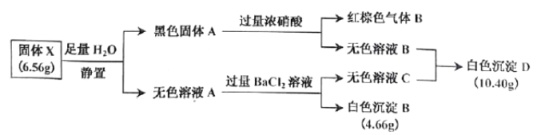
已知:白色沉淀 D 中的一种成分及质量与沉淀 B 相同。
(1)白色沉淀 D 的成分为_________(填写化学式)。
(2)黑色固体 A 与浓硝酸反应的离子方程式是_________。
(3)X 与 H2O 反应的化学方程式是_________。
Ⅱ.已知:①将 0.1 mol·Lˉ1KI 溶液加入到 0.1 mol·Lˉ1 FeCl3 溶液中时,可以看到溶液颜色加深,滴加淀粉后溶液变为蓝色;②当离子浓度相同时,氧化性:Ag+>Fe3+;③ 若浓度减小时,离子的氧化性也会随之减弱。
(1)甲同学猜测,0.1 mol·Lˉ1 KI 溶液(事先加入几滴淀粉溶液)加入到 0.1 mol·Lˉ1AgNO3 溶液中时,溶液应变蓝色。请写出该猜测对应的离子方程式_________。实 验结果未见到蓝色。
(2)乙同学认为甲同学的实验方案有问题,理由是_________。请你用原电池的方法证明Ag+也能氧化 Iˉ,要求画出实验装置图,并标明电极材料及电解质溶液 ________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com