
【题目】在100mL碳酸钠与碳酸氢钠的混合溶液中,加入氢氧化钡溶液,生成的沉淀如表:
实验序号 | 1 | 2 | 3 |
V(氢氧化钡溶液)/mL | 80 | 160 | 240 |
沉淀质量/g | 1.576 | 3.152 | 3.940 |
将实验3的悬浊液过滤,在滤液中加![]() 盐酸,恰好呈中性。
盐酸,恰好呈中性。
(1)氢氧化钡溶液的物质的量浓度为___。
(2)若将原100mL碳酸钠与碳酸氢钠的混合溶液加热蒸干并灼烧至恒重,得到![]() ___g。
___g。
【答案】![]() 0.22
0.22
【解析】
从离子方程式的角度进行分析。向碳酸钠和碳酸氢钠的混合溶液中加入氢氧化钡溶液,发生的离子反应有: HCO3-+OH-=H2O+CO32-、Ba2++CO32-=BaCO3↓。从实验2和实验3沉淀质量的变化来看,实验2显然没有沉淀完全,假设实验3中的240mL溶液仍能完全将Ba2+沉淀,应生成的沉淀的质量是![]() =4.728g>3.940g,所以实验3中溶液中的所有的碳酸钠和碳酸氢钠均已反应完全。
=4.728g>3.940g,所以实验3中溶液中的所有的碳酸钠和碳酸氢钠均已反应完全。
(1)据以上分析,实验2中加入的钡离子完全沉淀,发生反应Ba2++CO32-=BaCO3↓,n[Ba(OH)2]=n(Ba2+)=n(BaCO3)=![]() =0.016mol,所以c[Ba(OH)2]=
=0.016mol,所以c[Ba(OH)2]=![]() =0.1mol/L;
=0.1mol/L;
(2)240mL氢氧化钡溶液中氢氧化钡的物质的量为:0.24L×0.1mol/L=0.024mol,其中OH-的物质的量为0.048mol。实验3的滤液中加入100mL 0.38mol/L盐酸恰好完全中和剩余的OH-,其物质的量为0.038mol,所以100mL原混合溶液中HCO3-消耗的OH-的物质的量为:0.048mol-0.038mol=0.01mol,则据反应式HCO3-+OH-=H2O+CO32-可知原溶液中NaHCO3的物质的量为0.01mol。实验3中共生成BaCO3沉淀0.02mol,其中NaHCO3生成的BaCO3沉淀是0.01mol,所以碳酸钠生成的BaCO3沉淀是0.01mol,所以原溶液中含有Na2CO3 0.01mol。将原混合溶液加热蒸干并灼烧至恒重,只有碳酸氢钠受热分解:![]() ,0.01mol NaHCO3完全分解生成二氧化碳0.005mol,其质量为0.005mol×44g/mol=0.22g。
,0.01mol NaHCO3完全分解生成二氧化碳0.005mol,其质量为0.005mol×44g/mol=0.22g。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】Mg(OH)2是常用的阻燃材料。以白云石(CaCO3、MgCO3的混合物)为原料制备Mg(OH)2和CaCO3的工艺流程如下:
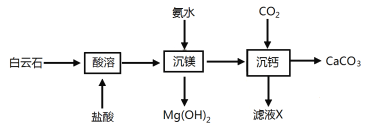
下列说法不正确的是
A.酸溶生成Mg2+的离子方程式是:MgCO3+2H+= Mg2++CO2↑+H2O
B.流程中可以循环利用的物质是CO2
C.酸溶过程中盐酸可用稀硝酸或硫酸代替
D.流程中没有涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
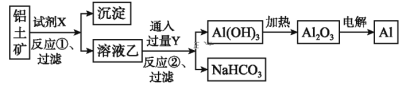
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为2NA
B.7gCnH2n中含有的氢原子数目为NA
C.任何气体单质在标况下体积若为22.4L,则含有2NA个原子
D.1molNa2O2与水反应转移的电子数约为1.204×1024个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组通过下列步骤测定某工厂废液中铜离子的浓度(已知废水中Fe3+对测定有干扰作用)。
i. 经检验废液中含有Fe3+离子,取V1 mL上述废液,加入NH4HF2,再加H2SO4酸化至pH<4,再次检测,未检验出Fe3+离子;
ii. 在上述溶液中,加入过量KI溶液,放置3 min,有沉淀CuI生成,立即用0.1000 mol/LNa2S2O3标准溶液滴定至浅黄色,加3 mL淀粉指示剂,继续滴定,至溶液变为浅蓝色;
iii. 再向上述溶液中加入10% KSCN溶液10 mL,继续滴定至终点,共消耗Na2S2O3溶液V2 mL。
已知:①CuI、CuSCN均为白色难溶物,CuI能吸附少量I2,CuSCN不吸附I2。
②I2在水溶液中溶解度较小,I-+I2![]() I3-、I-、I2、I3-的平衡体系溶液呈黄色
I3-、I-、I2、I3-的平衡体系溶液呈黄色
③I2+2S2O32-=2I-+S4O62-,S2O32-和S4O62-无色;
(1)①步骤i中检验含Fe3+离子操作和现象_______。
②已知 Fe3++6F-![]() [FeF6]3-,如果省略步骤i,则导致实验结果________(填“偏大”或 “偏小” ) 。
[FeF6]3-,如果省略步骤i,则导致实验结果________(填“偏大”或 “偏小” ) 。
(2)①步骤ii中生成沉淀的离子方程式_____________。
②步骤ii中加入的KI的量是理论值的2至3倍,其目的一是使Cu2+充分反应;二是__________。
(3)①步骤iii中加入KSCN溶液使ii中的沉淀转化为CuSCN沉淀,其目的是___________。
②步骤iii中判定滴定终点的现象是_____________。
(4)经小组测定,废液中c(Cu2+)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼烯是继石墨烯之后又一种“神奇纳米材料”,具有优良的导电、导热性能。科学家已成功合成多种结构的硼烯,如图为“皱褶”式硼烯的结构,下列说法正确的是

A.“皱褶”式硼烯中含B、H 两种元素
B.“皱褶”式硼烯中硼原子达到8电子稳定结构
C.硼的最高价氧化物对应水化物的酸性比碳酸的强
D.硼烯有望代替石墨烯作锂离子电池的电极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于摩尔质量的描述或应用中正确的是
A. 一个钠原子的质量等于![]() g B. 二氧化碳的摩尔质量是44 g
g B. 二氧化碳的摩尔质量是44 g
C. 铁原子的摩尔质量等于它的相对原子质量 D. 1 mol氢氧根离子的质量是17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,X是铁,Y是石墨电极,a是硫酸钠溶液,实验开始前,在U形管的两边同时各滴入几滴酚酞溶液,下列叙述正确的是( )

A. 闭合K1,断开K2,X极放出H2
B. 闭合K1,断开K2,Y极为阳极
C. 闭合K2,断开K1,Y极的电极反应式为O2+2H2O+4e-=4OH-
D. 闭合K2,断开K1,工作一段时间后,X电极附近溶液显红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )

A.只有①和②处B.只有②处C.只有②和③处D.只有②③④处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com