
【题目】体积固定的密闭容器中发生下列反应![]() ,在一定条件下已达平衡的事实是( )
,在一定条件下已达平衡的事实是( )
A. 容器内压强不变
B. 容器内A、B、C、D、E五者共存
C. A、D的消耗速率相等
D. D、C的生成速率相等
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,两种钠盐![]() 、
、![]() 溶液的物质的量浓度均为
溶液的物质的量浓度均为![]() ,加水稀释时溶液的
,加水稀释时溶液的![]() 与稀释倍数的对数
与稀释倍数的对数![]() 的关系如图所示。下列判断错误的是( )
的关系如图所示。下列判断错误的是( )
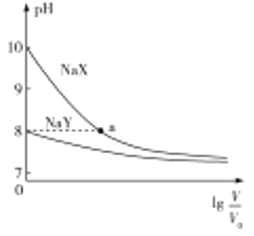
A.![]() 、
、![]() 均为弱酸,且
均为弱酸,且![]() 的酸性比
的酸性比![]() 的强
的强
B.![]() 的
的![]() 、
、![]() 溶液中,前者对水的电离促进作用较大
溶液中,前者对水的电离促进作用较大
C.![]() 点
点![]() 溶液中存在:
溶液中存在:![]()
D.随着溶液的稀释,![]() 溶液中
溶液中![]() 逐渐减小
逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备并收集干燥、纯净氯气的装置如图所示:

(1)写出实验室制备Cl2的化学方程式:___。
(2)写出指定试剂的名称,C__,D__。
(3)C的作用是__,D的作用是__,F的作用是___。
(4)检验氯气是否收集满的操作:___。
(5)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,其中该反应中HCl的作用是___,若反应产生0.5mol Cl2,则消耗的氧化剂的物质的量为___mol,反应转移的电子数是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
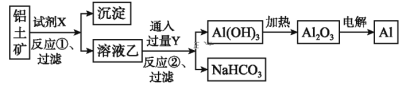
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化。其中A为金属试回答:

(1)写出B的化学式________________,D的化学式________________。
(2)写出由D转变成H的化学方程式________________。
(3)写出向G溶液加入A的有关离子反应方程式________________。
(4)写出E转变为F的实验现象为:_________________________化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为2NA
B.7gCnH2n中含有的氢原子数目为NA
C.任何气体单质在标况下体积若为22.4L,则含有2NA个原子
D.1molNa2O2与水反应转移的电子数约为1.204×1024个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组通过下列步骤测定某工厂废液中铜离子的浓度(已知废水中Fe3+对测定有干扰作用)。
i. 经检验废液中含有Fe3+离子,取V1 mL上述废液,加入NH4HF2,再加H2SO4酸化至pH<4,再次检测,未检验出Fe3+离子;
ii. 在上述溶液中,加入过量KI溶液,放置3 min,有沉淀CuI生成,立即用0.1000 mol/LNa2S2O3标准溶液滴定至浅黄色,加3 mL淀粉指示剂,继续滴定,至溶液变为浅蓝色;
iii. 再向上述溶液中加入10% KSCN溶液10 mL,继续滴定至终点,共消耗Na2S2O3溶液V2 mL。
已知:①CuI、CuSCN均为白色难溶物,CuI能吸附少量I2,CuSCN不吸附I2。
②I2在水溶液中溶解度较小,I-+I2![]() I3-、I-、I2、I3-的平衡体系溶液呈黄色
I3-、I-、I2、I3-的平衡体系溶液呈黄色
③I2+2S2O32-=2I-+S4O62-,S2O32-和S4O62-无色;
(1)①步骤i中检验含Fe3+离子操作和现象_______。
②已知 Fe3++6F-![]() [FeF6]3-,如果省略步骤i,则导致实验结果________(填“偏大”或 “偏小” ) 。
[FeF6]3-,如果省略步骤i,则导致实验结果________(填“偏大”或 “偏小” ) 。
(2)①步骤ii中生成沉淀的离子方程式_____________。
②步骤ii中加入的KI的量是理论值的2至3倍,其目的一是使Cu2+充分反应;二是__________。
(3)①步骤iii中加入KSCN溶液使ii中的沉淀转化为CuSCN沉淀,其目的是___________。
②步骤iii中判定滴定终点的现象是_____________。
(4)经小组测定,废液中c(Cu2+)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于摩尔质量的描述或应用中正确的是
A. 一个钠原子的质量等于![]() g B. 二氧化碳的摩尔质量是44 g
g B. 二氧化碳的摩尔质量是44 g
C. 铁原子的摩尔质量等于它的相对原子质量 D. 1 mol氢氧根离子的质量是17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质分类是基本的化学思路。下表是几种常见物质的分类情况:
单质 | 氧化物 | 酸 | 碱 | 盐 |
Mg、S、C、N2 | CaO、CO2 | HCl、H3BO3 | KOH、NH3 H2O | KNO3、K2S |
回答下列问题
(1)下列物质可导电的是_____________;是电解质的是_______________。
①HCl(液态) ②HCl(稀溶液) ③KOH(固体) ④KOH(熔融状态) ⑤KOH(稀溶液)
(2)从上表选择两种物质,发生反应属于化合反应但不属于氧化还原反应,该反应的化学方程式为_____________。(任写一个即可)
(3)点燃时,镁可以在氮气中燃烧,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目__________________。
(4)酸按不同标准分类得到的结果是不同的。已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH-=B(OH)4-,则H3BO3属于_____元酸,其电离方程式为______。
(5)黑火药是我国古代伟大的科学发明,反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,若生成22.4L N2(标准状况下),则被氧化的C是_________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com