
【题目】实验小组同学探究FeSO4分解反应并检验反应产物(加热及加持装置略)。下列有关FeSO4分解的说法不正确的是( )
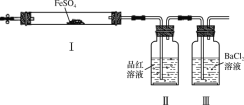
A.Ⅰ中固体变为红棕色,说明反应生成了Fe2O3
B.Ⅰ中反应需持续加热,说明FeSO4分解是吸热反应
C.Ⅱ中品红溶液颜色褪去,说明反应生成了SO2
D.Ⅲ中未产生白色沉淀,说明反应未生成SO3
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于0.1mol/LH2SO4溶液的叙述错误的是
A.1L该溶液中含有H2SO4的质量为9.8g
B.0.5L该溶液中氢离子的物质的量浓度为0.2mol/L
C.从1L该溶液中取出100mL,则取出的溶液中H2SO4的物质的量浓度为0.01mol/L
D.取该溶液10mL加水稀释至100mL后,H2SO4的物质的量浓度为0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃(含一个双键)组成,在同温同压下,混合气体对氢气的相对密度13,在标准状况下,将56L混合气体通入足量的溴水中,溴水的质量增重35g。
(1)计算确定混合气体中烃的化学式_____。
(2)混合气体中两种烃的物质的量之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是( )
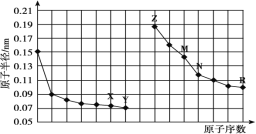
A.最高价氧化物对应水化物的碱性:Z<M
B.Y、R两种元素气态氢化物的稳定性:Y>R
C.X、N两种元素形成的化合物属于离子化合物
D.简单离子的半径:Z>M>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化和液化是高效、清洁地利用煤炭的重要途径,目前不少城市将焦炭在高温下与水蒸气反应制得水煤气,写出该反应的化学方程式_________________________说明固体煤经处理变为气体燃料使用的优点有____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.8 kJ·mol–1。
CH3OH(g) ΔH=-90.8 kJ·mol–1。
(1)在容积为1 L的恒容容器中,分别研究在230℃、250℃和270 ℃三种温度下合成甲醇的规律。
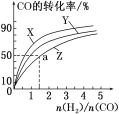
如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是_______。
Ⅱ.如图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。
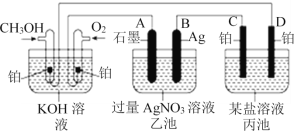
(2)乙池中A(石墨)电极的名称是______。
(3)通入CH3OH的电极的电极反应式为______。
(4)乙池中反应的化学方程式为_________
(5)当乙池中B(Ag)极的质量增加5.4 g时,甲池中理论上消耗O2 ________mL(标准状况),此时丙池某电极上析出1.60 g某金属,则丙池中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
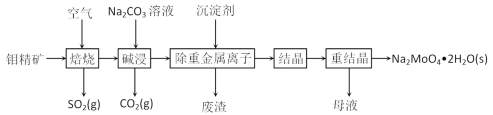
(1)提高焙烧效率的方法有:_____________(写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________。氧化产物是________________。
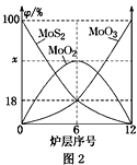
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为 ______________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20molL1,c(SO42-)=0.01molL1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________。〔已知Ksp(BaSO4)=1×1010,Ksp(BaMoO4)=2.0×108〕
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃主链上有4个碳原子的同分异构体有2种,含有相同碳原子数且主链上也有4个碳原子的单烯烃的同分异构体有( )
A. 2种 B. 4种
C. 5种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列变化进行推断:
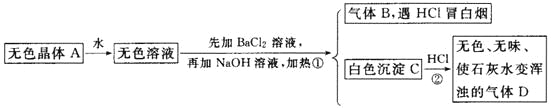
且已知对A加强热产生的气态物质的平均相对分子质量为26.3。
(1)推断A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出①②变化的离子方程式:
①________________________________________________________________;
②________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com