
【题目】根据下列变化进行推断:
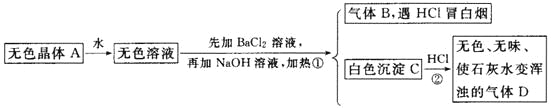
且已知对A加强热产生的气态物质的平均相对分子质量为26.3。
(1)推断A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出①②变化的离子方程式:
①________________________________________________________________;
②________________________________________________________________。
【答案】NH4 HCO3 NH3 BaCO3 CO2 ![]() +
+![]() +Ba2 + +2OH-
+Ba2 + +2OH- ![]() NH3 ↑+BaCO3 ↓+2H2O BaCO3 +2H+ ══Ba2 + +CO2 ↑+H2 O
NH3 ↑+BaCO3 ↓+2H2O BaCO3 +2H+ ══Ba2 + +CO2 ↑+H2 O
【解析】
气体B遇HCl冒白烟,则气体B为NH3,加氯化钡溶液后产生的白色沉淀C遇盐酸产生无色无味的气体能使石灰水变浑,则C为BaCO3 ,D为CO2,据此可推断无色溶液中应含有碳酸根离子和铵根离子,则A可能为NH4 HCO3或(NH4 )2CO3,如果是NH4 HCO3,则分解产生的气体的平均相对分子质量为![]() =26.3,如果是(NH4 )2CO3,则分解产生的气体的平均相对分子质量为
=26.3,如果是(NH4 )2CO3,则分解产生的气体的平均相对分子质量为![]() =24,根据对A加强热产生的气态物质的平均相对分子质量为26.3可知,A为NH4 HCO3,据此答题。
=24,根据对A加强热产生的气态物质的平均相对分子质量为26.3可知,A为NH4 HCO3,据此答题。
气体B遇HCl冒白烟,则气体B为NH3,加氯化钡溶液后产生的白色沉淀C遇盐酸产生无色无味的气体能使石灰水变浑,则C为BaCO3 ,D为CO2,据此可推断无色溶液中应含有碳酸根离子和铵根离子,则A可能为NH4 HCO3或(NH4 )2CO3,如果是NH4 HCO3,则分解产生的气体的平均相对分子质量为![]() =26.3,如果是(NH4 )2CO3,则分解产生的气体的平均相对分子质量为
=26.3,如果是(NH4 )2CO3,则分解产生的气体的平均相对分子质量为![]() =24,根据对A加强热产生的气态物质的平均相对分子质量为26.3可知,A为NH4 HCO3,据此答题。
=24,根据对A加强热产生的气态物质的平均相对分子质量为26.3可知,A为NH4 HCO3,据此答题。
(1)根据上面的分析可知,A为NH4 HCO3,B为NH3,C为BaCO3 ,D为CO2;
故答案为:NH4 HCO3;NH3;BaCO3 ;CO2;
(2)反应①的离子方程式为NH4++HCO3-+Ba2++2OH-═NH3↑+BaCO3↓+2H2O,反应②的离子方程式为BaCO3 +2H+═Ba2++CO2↑+H2 O;
故答案为:NH4++HCO3-+Ba2++2OH-═NH3↑+BaCO3↓+2H2O;BaCO3 +2H+═Ba2++CO2↑+H2 O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】同主族元素所形成的同一类型的化合物,往往其结构和性质相似。化合物![]() 是一种晶体,下列对它的叙述中,错误的是
是一种晶体,下列对它的叙述中,错误的是
A.它是一种离子化合物
B.这种化合物水溶液显中性
C.这种化合物加热能分解
D.这种化合物能与氢氧化钠溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电催化合成氨法在电能的推动下不受热力学平衡限制,实现N2、H2O常温常压合成氨,如图为N2在不同电极材料表面复化的机制示意图。下列说法正确的是( )
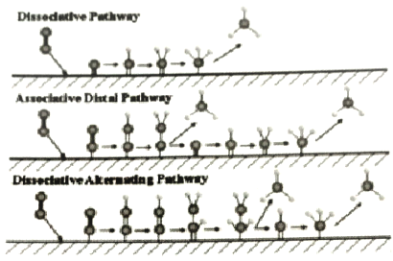
A.电极材料起吸附作用,不影响N2的氢化过程
B.N2在氢化反应之前需先解离成单独的氮原子
C.电催化合成氨原子利用率100%
D.2.8gN2理论上可以产生0.2NA个NH3分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的化学资源宝库,利用海水可以提取很多物质。
利用1:提溴工业
用海水晒盐之后的盐卤可提取溴,提取流程如图:
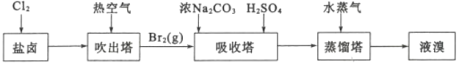
(1)吹出塔中热空气能将溴单质吹出的原因是_____。蒸馏塔中通入水蒸气进行加热,需要控制温度在90℃左右的原因是______。
利用2:提镁工业
从海水提取食盐和Br2之后的盐卤中除含有Mg2+、C1-外,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等,还可以用来提取MgCl2、MgO、Mg(OH)2等物质,流程如图所示:
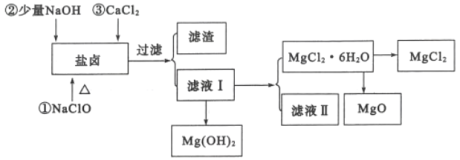
(2)用NaC1O除去尿素CO(NH2)2时,生成物除盐外,还有能参与大气循环的无毒物质,则该反应的化学方程式为_______;加入NaC1O的另一个作用是________。
利用3:淡化工业
(3)海水淡化的方法主要有闪蒸法、离子交换法、电渗析法等。离子交换法淡化海水模拟过程如图所示。氢型阳离子交换原理可表示为:HR+Na+=NaR+H+;……。羟型阴离子交换树脂填充部分存在的反应有:ROH+C1-=RC1+OH-;______;________。
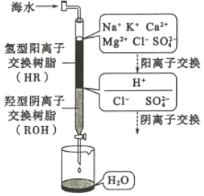
(4)电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示:
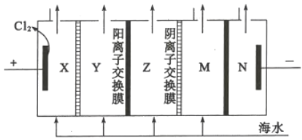
①图中的海水没有直接通入到阴极室中,其原因是_________。
②淡化水在________室(填X、Y、Z、M或N)形成后流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中选用的部分仪器,不合理的是( )
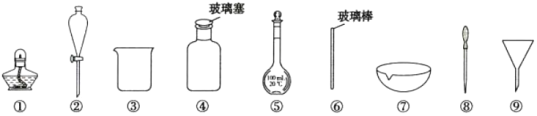
A.配制100 mL0.1 mol·L-1NaC1溶液,选用③、⑤、⑥和⑧
B.盛放NaOH溶液,选用④
C.分离I2的四氯化碳溶液和水,选用②、③
D.从食盐水中获得食盐,选用①、⑥、⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.氢离子的数目减少
B.溶液中![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用发烟HC1O4将潮湿的CrC13氧化为棕色的烟[CrO2(C1O4)2],来除去Cr(Ⅲ),HC1O4中部分氯元素转化为最低价态。下列说法错误的是( )
A.CrO2(C1O4)2中Cr元素显+6价
B.HC1O4属于强酸,该反应还生成了另一种强酸
C.该反应中,参加反应的氧化剂与氧化产物的物质的量之比为3:8
D.该反应离子方程式为19ClO![]() +8Cr3++8OH-=8CrO2(ClO4)2+3C1-+4H2O
+8Cr3++8OH-=8CrO2(ClO4)2+3C1-+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算下列各题在常温下的数值(lg2=0.3、lg3=0.477、lg5=0.7)。
(1)0.005mol/L的氢氧化钡溶液的PH=____。
(2)0.1mol/L的醋酸的PH=_____(电离度=1%)。
(3)pH=12的NaOH溶液加水稀释到原来的10倍,则溶液的pH=_____。
(4)pH=12氨水加水稀释到原来100倍,溶液的pH值范围___________。
(5)PH=1和PH=3的硫酸等体积混合后溶液的PH=______,c(H+)水=_____。
(6)pH=13 的强碱与 pH=2 的强酸溶液混合,所得混合液的 pH=11,则强碱与强酸的体积比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1molNaHSO4固体中含有离子总数为3NA
B.11.2L(标准状况)HF含有质子数为5NA
C.50g46%的乙醇水溶液中,含有O—H键数为3.5NA
D.1molCu与足量的硫蒸气反应,转移电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com