
| y |
| 4 |
| z |
| 2 |
| 一定条件 |
| Cu |
| △ |
| 一定条件 |
| Cu |
| △ |
| 4.48L |
| 22.4L/mol |
| 5.4g |
| 18g/mol |
| 1.6g |
| 16g/mol |
| 3.2g |
| 16g/mol |
| 6 |
| 4 |
| 6 |
| 4 |
| 1 |
| 2 |
| 6 |
| 4 |


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
| A、加水的体积为vL |
| B、加水的质量为mg |
| C、0.5amol/L的氨水质量分数等于0.5b% |
| D、0.5amol/L的氨水质量分数小于0.5b% |
查看答案和解析>>
科目:高中化学 来源: 题型:
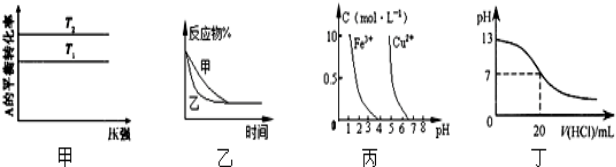
| A、图甲可以判断出反应A(g)+B(g)?2C(g)的△H<0,T2>T1 |
| B、图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C、依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量的CuO,调节pH≈4 |
| D、图丁表示25℃时,用0.1 mol/L 盐酸滴定20 ml 0.1mol/LNaOH溶液,溶液的pH随加入盐酸体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在AsCl3分子中,砷原子最外层电子数为8 |
| B、Na3AsO4溶液的pH等于7 |
| C、砷的氢化物的化学式为AsH3,其还原性比NH3的弱 |
| D、第一电离能:As<Se |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、交叉分类法和树状分类法是化学上仅有的两种分类方法 |
| B、化合物中某元素处于最高价只能被还原 |
| C、H2SO4在电流作用下在水中电离出H+和SO42- |
| D、偏二甲肼(分子式:C2H8N2)是一种有机高能燃料,它的摩尔质量为60g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com