
【题目】硝酸在化学工业中有着极其广泛的应用。
(1)将1.25mol的NO、NO2、N2O4混合物(其中NO的体积分数为0.60)通入水中,在空气充足的条件下完全反应后可获得硝酸的物质的量范围是_______________。
(2)向稀硝酸中加入18.4mol/L的浓硫酸(98%)作吸水剂并蒸馏得浓硝酸,当其浓度下降到87%(密度1.8g/cm3)以下时,则失去吸水能力。50mL 18.4mol/L的浓硫酸作为吸水剂时,最多可吸水_________ g。
(3)在65%的HNO3(质量m1)中加入72%的Mg(NO3)2(质量m2)后蒸馏,分别得到97.5%的HNO3和60%的Mg(NO3)2溶液(其中不含硝酸)。若蒸馏过程中,硝酸、硝酸镁均无损耗,H2O的损耗占总质量的5%,则蒸馏前投料比![]() =______________。
=______________。
(4)硝酸工业中的尾气用烧碱进行吸收产物为NaNO2、NaNO3和H2O。现有含0.50mol氮氧化物的尾气,恰好被一定量的NaOH溶液完全吸收。已知反应后溶液含有0.35mol NaNO2。若将尾气NO和NO2的平均组成用NOx表示,则x =___________。
【答案】1.25mol<n(HNO3)<1.75mol 11.63 0.88 1.80
【解析】
(1)1.25molNO、NO2、N2O4混合物,NO的体积分数为0.60,所以n(NO)=1.25×0.6=0.75mol,n(NO2+N2O4)=1.25-0.75=0.5mol,因为在空气充足的条件下完全反应,所有N全都转变成硝酸,据N原子守恒当0.5mol全为二氧化氮时生成硝酸最少物质的量=1.25mol,若全为四氧化二氮生成硝酸最多为:0.75+0.5×2=1.75mol,即1.25mol<n(HNO3)<1.75mol;
(2)据已知信息,18.4 mol/L的浓硫酸吸完水后变为87%,假设浓硫酸体积为1L,吸收水的质量为m g,则有:(18.4×98)÷(18.4×98÷98%+m )×100%="87%" ,计算得m=232.6g,所以50mL 18.4mol/L的浓硫酸作为吸水剂时,最多可吸水232.6×0.05=11.63g;
(3)设蒸馏后硝酸溶液质量为a g,硝酸镁溶液质量为b g,蒸馏前后溶质质量不变,则有65%m1=97.5%a,a=![]() m1;72%m2=60%b,b=1.2m2;因为蒸馏前后水减少了5%,所以剩余质量为95%,则95%(m1+m2)=a+b,即:(m1+m2)×95%=
m1;72%m2=60%b,b=1.2m2;因为蒸馏前后水减少了5%,所以剩余质量为95%,则95%(m1+m2)=a+b,即:(m1+m2)×95%=![]() m1+1.2m2,
m1+1.2m2,![]() =0.88;
=0.88;
(4)据氮原子守恒得,0.5mol NOx中N共0.5mol,生成NaNO2、NaNO3一共也是0.5mol,n(NaNO2)= 0.35mol,所以n(NaNO3)=0.5-0.35=0.15mol,即n(NaNO2):n(NaNO3)=7:3,据以上信息可写出反应方程式:10NOx+10NaOH=7NaNO2+3NaNO3+5H2O,据氧原子守恒得x=1.80。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】CO2是一种常见的温室气体,它的吸收和利用也成为现代科技的热门课题。
(1)恒容密闭容器中,在Cu/ZnO催化剂作用下,可用CO2制备甲醇:CO2(g) + 3H2(g)CH3OH(g) + H2O(l) △H1,已知: CH3OH(g) +![]() O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式________(△H用△H1、 △H2表示)。某温度下,在体积为2L的密闭容器中加入2mol CO2、5mol H2以及催化剂进行反应生成CH3OH 蒸气和水蒸气,达到平衡时H2的转化率是60%,其平衡常数为_______。
O2(g)=CO2(g) + 2H2O(l) △H2,写出氢气燃烧热的热化学方程式________(△H用△H1、 △H2表示)。某温度下,在体积为2L的密闭容器中加入2mol CO2、5mol H2以及催化剂进行反应生成CH3OH 蒸气和水蒸气,达到平衡时H2的转化率是60%,其平衡常数为_______。
(2)工业上用CO2催化加氢制取二甲醚:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)。在两个相同的恒容密闭容器中,充入等量的反应物,分别以Ir和Ce作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示:
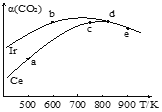
①用Ir和Ce作催化剂时,反应的活化能更低的是_________;
②a、b、c、d和e五种状态,反应一定达到平衡状态的是________,反应的ΔH ____0(填“>”、“=”或“<”);
③从状态a到c,CO2转化率不断增大的原因是__________;
④已知T℃下,将2 molCO2和6 molH2通入到体积为V L的密闭容器中进行上述反应,反应时间与容器内的总压强数据如表:
时间t/min | 0 | 10 | 20 | 30 | 40 |
总压强p/1000kPa | 1.0 | 0.83 | 0.68 | 0.60 | 0.60 |
该反应平衡时CO2的转化率为___________。
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,得到NH4HCO3溶液,则反应NH4++HCO3-+H2ONH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z是合成某种抗结核候选药物的重要中间体,可由下列反应制得。
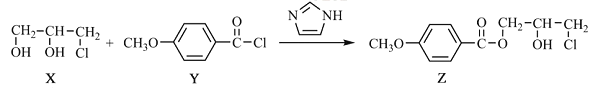
下列有关化合物X、Y和Z的说法正确的是
A.X分子中不含手性碳原子
B.Y分子中的碳原子一定处于同一平面
C.Z在浓硫酸催化下加热可发生消去反应
D.X、Z分别在过量NaOH溶液中加热,均能生成丙三醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置制备溴苯,下列说法错误的是

A. 装置A中长玻璃导管仅起冷凝回流作用,装置B中的实验现象是CCl4由无色变橙色
B. 若装置B后连接装置C,装置C中生成淡黄色沉淀,可证明装置A中发生取代反应
C. 若装置B后连接装置D,则装置D的作用是吸收尾气
D. 向反应后的装置A中加入NaOH溶液,振荡静置,下层为无色油状液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.04 g铜镁合金完全溶解于100 mL 14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体2240 mL(标准状况),向反应后的溶液中加入2.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2∶1
B.被还原的硝酸的物质的量是0.12 mol
C.得到5.08 g沉淀时,加入NaOH溶液的体积是700 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室由炼钢污泥(简称铁泥,主要成份为铁的氧化物)制备软磁性材料α-Fe2O3。
其主要实验流程如下:
![]()
(1)酸浸:用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有___________(填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成___________(填化学式);检验Fe3+是否还原完全的实验操作是______________。
(3)除杂:向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是___________[![]() ,
,![]() ]。
]。
(4)沉铁:将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为____________。
②设计以FeSO4溶液、氨水- NH4HCO3混合溶液为原料,制备FeCO3的实验方案:__。
(FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸钡与盐酸反应2H++BaCO3===Ba2++H2O+CO2↑
B. 氢氧化钡溶液与稀硫酸混合Ba2++![]() +H++OH-===BaSO4↓+H2O
+H++OH-===BaSO4↓+H2O
C. 金属钠与水的反应 Na+H2O===Na++OH-+H2↑
D. 铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a. 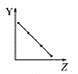 b.
b. 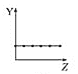 c.
c.  d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某温度下,将2molSO2和1molO2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2molSO2和1molO2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A.由图甲知,A点SO2的平衡浓度为0.08mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达到平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50MPa时不同温度下SO2的转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com