
【题目】将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,反应后Fe有剩余,则容器中其它存在的单质或离子只能是
A. Cu、Fe3+ B. Fe2+、Fe3+ C. Cu、Cu2+ D. Cu、Fe2+
科目:高中化学 来源: 题型:
【题目】苯的同系物中,有的侧链能被KMnO4酸性溶液氧化,生成芳香酸,反应如下:
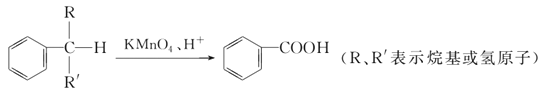
(1)现有苯的同系物甲、乙,分子式都是C10H14,甲不能被KMnO4酸性溶液氧化为芳香酸,它的结构简式是______________;乙能被KMnO4酸性溶液氧化为分子式为C8H6O4的芳香酸,则乙可能的结构有________种。
(2)有机物丙也是苯的同系物,分子式也是C10H14,它的苯环上的一溴代物只有一种,试写出丙所有可能的结构简式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应(均未配平)中,氧化剂与还原剂物质的量的关系为1∶2的是
A. Cu+H2SO4![]() CuSO4+SO2↑+H2O
CuSO4+SO2↑+H2O
B. CH3COOH+Ca(ClO)2![]() HClO+Ca(CH3COO)2
HClO+Ca(CH3COO)2
C. I2+NaClO3![]() NaIO3+Cl2
NaIO3+Cl2
D. HCl+MnO2![]() MnCl2+Cl2↑+H2O
MnCl2+Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)①已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol–1
2SO3(g) ΔH=196.6 kJ·mol–1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=113.0 kJ·mol–1
2NO2(g) ΔH=113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO2的同时生成1 molNO2
(2)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g ) △H=-116kJ/mol
CH3OH ( g ) △H=-116kJ/mol
一定条件下在2L密闭容器中,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇。
① 2min时测得生成CH3OH 0.2mol,则0~2min的平均反应速率v(H2)= 。
②反应5min后达到平衡,若平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
a.c(H2)减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c(H2)/c(CH3OH)减小
(3)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P) 的关系如图所示。
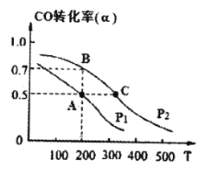
A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“>”、“<”或“=”)。
② 若A点时容器的体积为1 L,则该温度下B的平衡常数 KB= ,C点的平衡常数KC KB(填“<”、“>”或“=”)。
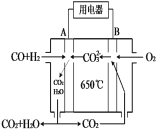
(4)下图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3共熔混合物为电解质。A为电池的 极(选填“正”或“负”),写出B极电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用4×10-3 mol的KZO4 恰好将60 mL 0.1 mol/L的Na2SO3溶液氧化为Na2SO4,则元素Z在还原产物中的化合价是
A. +6 B. +4 C. +3 D. +2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全充满或半充满。
(1)写出A、B元素的元素符号:A________,B________。
(2)写出C元素基态原子核外电子排布式:C______________________________。
(3)写出D元素基态原子核外电子轨道表示式:D_____________________________。
(4)写出B、C两种元素单质在一定条件下反应的化学方程式:___________________。
(5)写出B元素单质和氢化物的电子式:单质________,氢化物__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:
![]()
则下列有关比较中正确的是( )
A. 第一电离能:④>③>②>① B. 原子半径:④>③>②>①
C. 电负性:④>③>②>① D. 最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
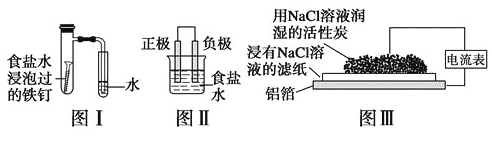
A. 按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B. 图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C. 铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D. 图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com