
【题目】下列各组离子一定能大量共存的是( )
①“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+
②加入KSCN显红色的溶液:K+、NH![]() 、Cl-、S2-
、Cl-、S2-
③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO![]() 、K+
、K+
④pH=2的溶液中:NH![]() 、Na+、Cl-、Cu2+
、Na+、Cl-、Cu2+
⑤由水电离出的c(OH-)=1×10-13molL-1的溶液中Mg2+、Ba2+、Cl-、Br-
A.②③B.①③C.①⑤D.③④
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)NO2(g)△H=+57kJmol﹣1,在温度为T时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的为( )

A.A、C两点的反应速率:v(A)>v(C)
B.A、C两点气体的颜色:A深,C浅
C.B点正逆反应速率:v(正)>v(逆)
D.A、C两点气休的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3molP和2.5molQ置于2L密闭容器中,发生如下反应:3P(g)+Q(g)![]()
![]() xM(g)+2N(g),5min后达到平衡,生成N1mol,经测定M的平均速率是0.1mol/(Lmin),下列叙述错误的是( )
xM(g)+2N(g),5min后达到平衡,生成N1mol,经测定M的平均速率是0.1mol/(Lmin),下列叙述错误的是( )
A. P的平均反应速率是0.15mol/(Lmin)
B. Q的转化率是25%
C. Q的平衡浓度是1mol/L
D. x的值为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关气体体积的叙述正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积指1mol任何气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)=2C(g),反应过程中C的百分含量与温度关系如图,下列正确的是

A.正反应速率:v(c)>v(d)>v(b)
B.化学平衡常数:K(d)>k(c)
C.c向d变化时,v(正)<v(逆)
D.d点状态加入合适的催化剂可使c%增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子检验的说法中正确的是( )
A.向某溶液中加稀盐酸,将产生的无色无味气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定含有大量CO![]()
B.向某溶液中加入盐酸酸化的硝酸钡溶液,有白色沉淀产生,则原溶液中一定有SO![]()
C.向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液呈碱性
D.向某溶液中加入硝酸银溶液产生白色沉淀,再加稀硝酸,沉淀不消失,则原溶液中一定有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种短周期元素的位置如图所示(其中乙、丙、丁的位置未标出)。
![]()
已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等。
(1)甲元素在周期表中的位置为______________。
(2)丙、丁可形成AB2型化合物,其化学式为________。
(3)丙是自然界中形成化合物种类最多的元素,则丙是________(填名称),其单质与甲元素的最高价氧化物对应水化物的浓溶液共热时反应的化学方程式是______________________。
(4)若甲、乙、丙、丁四种元素两两化合时,丁与其他三种元素得到的化合物种类最多,则丁是________(填元素符号),写出这些化合物中任意两种符合以下条件的化学式______________________
(①原子个数比为1∶2;②分子中价电子总数为偶数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含![]() 、
、![]() 、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
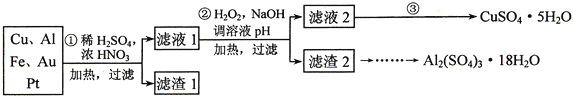
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法: |
方法Ⅲ | 用肼 |
![]() 第
第![]() 步Cu与混酸反应的离子方程式为______
步Cu与混酸反应的离子方程式为______![]() 得到滤渣1的主要成分为______。
得到滤渣1的主要成分为______。
![]() 第
第![]() 步中加入
步中加入![]() 的作用是______,使用
的作用是______,使用![]() 的优点是______;调溶液pH的目的是______。
的优点是______;调溶液pH的目的是______。
![]() 简述第
简述第![]() 步由滤液2得到
步由滤液2得到![]() 的方法是______。
的方法是______。
![]() 由滤渣2制取
由滤渣2制取![]() ,设计了以下三种方案:
,设计了以下三种方案:
甲:滤渣![]() 酸浸液
酸浸液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
乙:滤渣![]() 酸浸液
酸浸液![]() 滤液
滤液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
丙:滤渣2![]() 滤液
滤液![]() 溶液
溶液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
上述三种方案中,______方案不可行,原因是______;从原子利用率角度考虑,______方案更合理。
![]() 用滴定法测定
用滴定法测定![]() 含量.取ag试样配成100mL溶液,每次取
含量.取ag试样配成100mL溶液,每次取![]() ,消除干扰离子后,用c
,消除干扰离子后,用c![]()
![]() 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b![]() 滴定反应如下:
滴定反应如下:![]() 写出计算
写出计算![]() 质量分数的表达式
质量分数的表达式![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠![]() ,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
(1)![]() 中S的化合价为______。
中S的化合价为______。
(2)向锌粉的悬浮液中通入![]() ,制备
,制备![]() ,生成
,生成![]()
![]() ,反应中转移的电子数为____mol;向
,反应中转移的电子数为____mol;向![]() 溶液中加入适量
溶液中加入适量![]() ,生成
,生成![]() 并有沉淀产生,该反应的化学方程式为_________
并有沉淀产生,该反应的化学方程式为_________
(3)![]() 电池具有高输出功率的优点。其正极为可吸附
电池具有高输出功率的优点。其正极为可吸附![]() 的多孔碳电极,负极为金属锂,电解液为溶解有
的多孔碳电极,负极为金属锂,电解液为溶解有![]() 的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为
的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为![]() ,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com