
【题目】某学生设计氨催化氧化实验,并将制得NO进一步氧化为NO2用水吸收NO2,并检验HNO3的生成。
可供选择的固体药品有:NH4Cl、Ca(OH)2、KClO3、MnO2、CaO
可供选择的液体药品有:浓氨水、过氧化氢、浓盐酸、水
可供选择的仪器有:如图
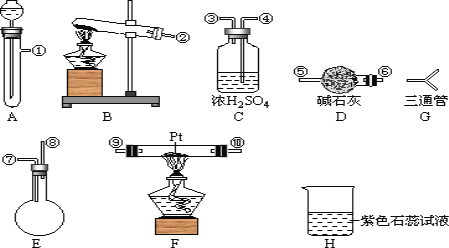
另有铁架台、铁夹、铁圈、乳胶管若干,可供选择。设计实验时,A和B两个制气装置允许使用两次,其余装置只能使用一次。
(1)氨氧化制NO的化学反应为__________________________,该反应应在装置____中进行。
(2)为快速制NH3和O2,制取NH3的装置最好选择_______,其化学反应方程式为______________;制取O2的装置最好选择_______。
(3)装置C的作用是___________________。
(4)装置H中溶液变红,其原因是(用化学方程式表示)______________________。
【答案】4NH3+5O2![]() 4NO+6H2OFANH3·H2O(浓)+CaO=NH3↑+Ca(OH)2A吸收多余NH3及生成 H2O4NO2+O2+2H2O=4HNO3
4NO+6H2OFANH3·H2O(浓)+CaO=NH3↑+Ca(OH)2A吸收多余NH3及生成 H2O4NO2+O2+2H2O=4HNO3
【解析】
(1)氨气与氧气在催化剂条件下加热生成一氧化氮和水,根据反应条件和反应物状态选择装置;
(2)要快速制备氨气,则应该是将生石灰加入到浓氨水中,据此选择装置及写出方程式;双氧水在催化剂条件下,不需要加热就会迅速产生大量氧气,据反应物状态和反应条件选择发生装置;
(3)氨气与浓硫酸反应,可以用浓硫酸吸收过量的氨气和气体中的水蒸气;
(4)因为NO2和剩余的氧气溶于水会有硝酸生成,溶液显酸性,因此石蕊试液变为红色。
(1)氨气与氧气在催化剂条件下加热生成一氧化氮和水,化学方程式为: 4NH3+5O2![]() 4NO+6H2O;因为是两种气体之间的反应,所以根据装置的特点可以知道,应选择装置F制备;因此本题答案是:4NH3+5O2
4NO+6H2O;因为是两种气体之间的反应,所以根据装置的特点可以知道,应选择装置F制备;因此本题答案是:4NH3+5O2![]() 4NO+6H2O;F。
4NO+6H2O;F。
(2)要快速制备氨气,则应该是将生石灰加入到浓氨水中,所以选择的装置是A,反应的化学方程式是NH3·H2O(浓)+CaO=NH3↑+Ca(OH)2 ;双氧水在催化剂条件下,不需要加热就会迅速产生大量氧气,反应物状态为固体与液体,条件不加热,选择装置A;综上所述,本题答案是:A ,NH3·H2O(浓)+CaO=NH3↑+Ca(OH)2,A。
(3)C中的浓硫酸用来吸收过量的氨气,干燥气体吸收水蒸气;因此,本题正确答案是: 吸收多余NH3及生成 H2O。
(4)因为NO2和剩余的氧气溶于水会有硝酸生成,溶液显酸性,因此石蕊试液变为红色,反应的化学方程式是: 4NO2+O2+2H2O=4HNO3;因此本题答案是:4NO2+O2+2H2O=4HNO3。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:反应aA(g)+bB(g)cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。

(1)经测定前4 s内v(C)=0.05 mol·L1·s1,则该反应的化学方程式为______________。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L1·s1;乙:v(B)=0.12 mol·L1·s1;丙:v(C)=9.6 mol·L1·min1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为___________(用甲、乙、丙表示)。
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号 | 操作 | 实验现象 |
① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入1~2 滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5 ℃左右冷水的烧杯中;将试管B放入盛有40 ℃左右热水的烧杯中 | 试管A中不再产生气泡试管B中产生的气泡量增大 |
② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未见气泡产生 |
(3)实验①的目的是_______________________________,实验中滴加FeCl3溶液的目的是____________________________。
(4)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是______________________________________________________________(用实验中所提供的几种试剂)。

(5)某同学在50 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如右图所示,则A、B、C三点所表示的即时反应速率最慢的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2A(g)![]() 2B(g)+E(g) ΔH>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
2B(g)+E(g) ΔH>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A. 加压 B. 升温 C. 减少E的浓度 D. 降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 足量的KI溶液与FeCl3溶液反应后,用CCl4萃取其中的I2,分液,在水溶液中滴加KSCN溶液仍呈血红色,说明该反应有一定的限度
B. 在一定条件下,一份双氧水样品经过2 h,H2O2的浓度从0.05 mol·L-1下降到0.03 mol·L-1,H2O2在这2 h中分解的平均反应速率约为0.015 mol·L-1·h-1
C. 其他条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢
D. 一定条件下,固定体积的容器中发生反应A(g)+B(g) ![]() 2C(g),当容器内A、B、C的浓度之比为1∶1∶2时,该反应处于平衡状态
2C(g),当容器内A、B、C的浓度之比为1∶1∶2时,该反应处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、100 g 16.0%的的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
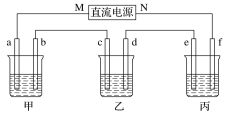
接通电源,经过一段时间后,测得丙中K2SO4的质量分数为12.20%,乙中c电极质量增加。据此回答问题:
(1)电源的N端为________极。
(2)电极b上发生的电极反应式为____________________________________________
(3)电极b上生成的气体在标准状况下的体积_________________。
(4)电极c的质量变化是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3+5O2![]() 4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
A. v(NO)=0.1 mol·(L·s)-1 B. v(NO)=0.02 mol·(L·s)-1
C. v(NH3)=0.01 mol·(L·s)-1 D. v(NH3)=0.2 mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是某种药物合成的中间体,其合成路线如下:
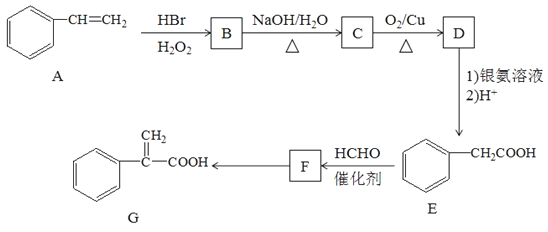
已知:①CH3-CH=CH2+HBr![]() CH3-CH2-CH2Br
CH3-CH2-CH2Br
②CH3COOH+HCHO![]() HOCH2CH2COOH
HOCH2CH2COOH
请回答下列问题:
(1)A的名称为___________________________。
(2)F中官能团名称是______________________________;E转化F的反应类型是_________________。
(3)F转化为G的化学方程式:_________________________________________。
(4)化合物F有多种同分异构体,满足下列条件的同分异构体有__________种。
①属于芳香族化合物且苯环上有两个取代基;
②能发生水解反应和银镜反应;
③与FeCl3溶液发生显色反应。
其中核磁共振氢谱图有6组峰且峰面积之比为1:2:2:2:2:1的有机物的结构简式为__________________;
(5)参照上述合成路线设计一条由CH3CHBrCH3和C2H5OH制备CH3CH2COOC2H5的合成路线(其他试剂自选)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g) ![]() 3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
A.4molA+2molB B.3molC+1molB+1molD+1molA
C.2molA+1molB+1molD D.1molA+0.5molB + 1.5molC+0.5molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装 置的开关时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为_____(填“原电池”“电解池”或“电镀池”),通入 CH3OH 电极的电极反应为_____。
(2)乙池中 A(石墨)电极的名称为_____(填“正极”“负极”或“阴极”“阳极”),总反应为__________。
(3)当乙池中 B 极质量增加 5.4 g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状 况),丙池中_____(填“C”或“D”)极析出_____g 铜。
(4)若丙中电极不变,将其溶液换成 NaCl 溶液,开关闭合一段时间后,甲中溶液的 pH将_____(填“增大”“减小”或“不变”,下同),丙中溶液的 pH 将______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com