
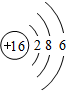 ;故答案为:
;故答案为: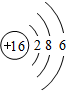 ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 已知醋酸是日常生活中常见的弱酸.
已知醋酸是日常生活中常见的弱酸.查看答案和解析>>
科目:高中化学 来源: 题型:
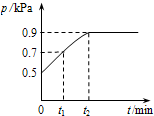 在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )A、从反应开始到t1时的平均反应速率v(X)=
| ||
| B、该温度下此反应的平衡常数K=0.32 | ||
| C、欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | ||
| D、其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
 为碳原子,
为碳原子, 为硅原子).每个碳原子周围与其距离最近的硅原子有
为硅原子).每个碳原子周围与其距离最近的硅原子有查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| X | 其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素第一电离能比其同周期的后一种元素高 |
| Y | 在地壳中的含量居于第三位,单质通常由电解法制取 |
| Z | 原子核外有五种不同能量的电子,且最外层有2个未成对电子 |
| T | 其合金在生产和生活中用量最大,原子核外有4个电子层,在化学反应中可以失去最外层的2个电子和次外层的1个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④ | B、①③ | C、①③④ | D、①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com