
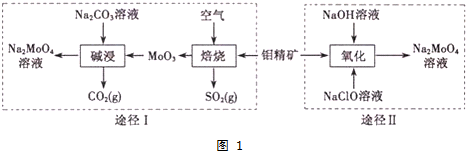

分析 利用钼精矿(主要成分是MoS2)制备钼酸钠有两种途径:途径Ⅰ是先在空气中灼烧生成MnO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MnO3,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体;途径Ⅱ是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体;据此分析解答:
(1)NaClO是离子型化合物,含有Na+和ClO-;
(2)焙烧时钼精矿(主要成分是MoS2)与空气中的氧气反应生成MoO3和 SO2;
(3)途径I碱浸时MoO3和纯碱溶液反应生成钼酸钠,同时得到CO2气体,反应方程式为MoO3+Na2CO3=Na2MoO4+CO2↑;
(4)途径Ⅱ用NaClO在碱性条件下氧化MoO3,得到钼酸钠和NaCl和水,据此可写出离子反应方程式;
(5)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,将NH3和CO2或SO2一起通入水中可生成碳酸盐或亚硫酸盐和水,反应方程式为CO2+2NH3+H2O=(NH4)2CO3或NH3+H2O+CO2=NH4HCO3,前者生成的盐为正盐,后者为酸式盐;
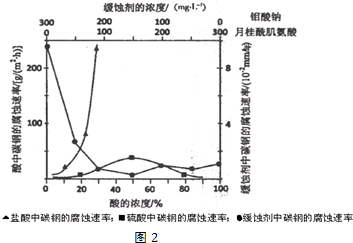
(6)①根据图象分析,在缓蚀剂中碳钢的腐蚀速率速率最小,腐蚀效果最好,最好的腐蚀效果在中点处;
②浓硫酸有强氧化性,能使金属表面形成致密的氧化膜保护层;
③根据图示数据分析碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异的原因;
(7)根据锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2$?_{充电}^{放电}$Lix(MoS2)n,可知锂是还原剂,在负极发生氧化反,是还原剂在正极发生氧化反应,据此书写电池放电时的正极反应式.
解答 解:利用钼精矿(主要成分是MoS2)制备钼酸钠有两种途径:途径Ⅰ是先在空气中灼烧生成MnO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MnO3,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体;途径Ⅱ是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体;据此分析解答:
(1)离子化合物NaClO的电子式为 ,故答案为:
,故答案为: ;
;
(2)焙烧时钼精矿(主要成分是MoS2)与空气中的氧气反应生成MoO3和 SO2,反应的方程式为2MoS2+7O2$\frac{\underline{\;高温\;}}{\;}$2MoO3+4 SO2,
故答案为:2MoS2+7O2$\frac{\underline{\;高温\;}}{\;}$2MoO3+4 SO2;
(3)途径I碱浸时发生反应的化学方程式为MoO3+Na2CO3═Na2MoO4+CO2↑,
故答案为:MoO3+Na2CO3═Na2MoO4+CO2↑;
(4)途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,
故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(5)CO2和NH3一起通入水中生成的正盐为碳酸铵,化学式为(NH4)2CO3,如果是SO2气体则生成正盐为(NH4)2SO3,
故答案为:(NH4)2CO3或(NH4)2SO3;
(6)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1,答案为:1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,
故答案为:常温下浓硫酸具有强氧化性,会使铁钝化;
③由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢,
故答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀;
(7)根据锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2$?_{充电}^{放电}$Lix(MoS2)n,可知锂是还原剂,在负极发生氧化反,是还原剂在正极发生氧化反应,正极反应式为nMoS2+xLi++xe-=Lix(MoS2)n,
故答案为:nMoS2+xLi++xe-=Lix(MoS2)n.
点评 本题考查制备钼酸钠晶体的工业制备方法,涉及利用化学用语分析反应原理、电化学知识,解题关键是分析题中图示,最后一问有一定的难度,容易出错,本题难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 向豆浆中加入硫酸钙做豆腐 | |
| B. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | 观看电影时,从放映机到银幕有明显的光路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中氧化剂和还原剂一定是两种物质 | |
| B. | 氧化还原反应中氧化产物和还原产物一定是两种物质 | |
| C. | 作氧化剂的物质一定不能作还原剂 | |
| D. | 所含元素处于中间价态时的物质,既可作氧化剂也可作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应,吸热反应的生成物总能量一定高于反应物总能量 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g) 在光照和点燃条件下的△H不同 | |
| C. | 一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| D. | 一定条件下4 HCl(g)+O2(g)═2Cl2(g)+2H2O(g),当1 mol O2反应放出115.6 kJ热量,键能如下所示,则断裂1 mol H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ Cl2(g)$\stackrel{243kJ/mol}{→}$2Cl(g) O2(g)$\stackrel{498kJ/mol}{→}$2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
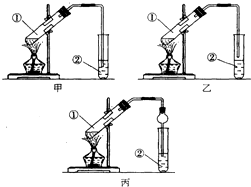 下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.
下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com