
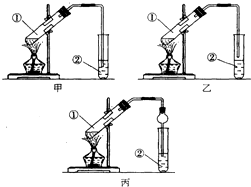
 �����Ǽס��ҡ�����λͬѧ��ȡ���������Ĺ��̣�������벢Э������������ʵ������
�����Ǽס��ҡ�����λͬѧ��ȡ���������Ĺ��̣�������벢Э������������ʵ���������� ��װ����ơ����������л����Ҵ������ᣬ����������ˮ������������
���������ۡ�������Ҵ���Ũ���������·���������Ӧ����������������ˮ����������������ˮ������ζ������̼������Һ�������Ҵ�����ȥ���ᣬ���������������ܽ�ȣ�ʹ��ֲ㣬���÷�Һ�ķ������룻�Ҵ���ͭ����������ʱ������ȩ��ˮ��
��� �⣺��װ����ơ����������л����Ҵ������ᣬ����������ˮ������������������װ����ȡ����ͬѧ����װ���еIJ����ܸij������θ���ܳ������������⣬�����ݻ��ϴ�Ҳ����ֹ���������ã�
�ʴ�Ϊ���ң���������
���������ۡ�a��������������ɫ��״Һ�壬������ˮ������ζ��
�ʴ�Ϊ��������ˮ������ζ��
b��ʵ�������ñ���̼������Һ��ȴ����������ԭ��һ������̼������Һ�е�ˮ�ܽ��Ҵ����Ҵ���ˮ����ܽ�ȴ�������������������̼�����ܸ����ᷴӦ������������ŵ�������������ζ�����������������ڱ���̼������Һ�������Ϳ��Ի�ý�Ϊ��������������Һ�壬���Ա���̼�������ã������Ҵ�����ȥ���ᣬ���������������ܽ�ȣ�ʹ��ֲ�������
�ʴ�Ϊ��ABC��
c���ñ���̼������Һ���������������õ�����Һ�廥�����ܣ������÷�Һ�����룬�ʴ�Ϊ����Һ��
d��������Ҵ���Ũ���������·���������Ӧ����������������ˮ����ѧ����ʽΪ��CH3COOH+C2H5OH$?_{��}^{Ũ����}$CH3COOC2H5+H2O��
�ʴ�Ϊ��CH3COOH+C2H5OH$?_{��}^{Ũ����}$CH3COOC2H5+H2O��
e���Ҵ���ͭ����������ʱ������ȩ��ˮ����Ӧ����ʽΪ��2CH3CH2OH+O2$��_{����}^{ͭ����}$2CH3CHO+2H2O��
�ʴ�Ϊ��2CH3CH2OH+O2$��_{����}^{ͭ����}$2CH3CHO+2H2O��
���� ���⿼�������������Ʊ�����Ŀ�ѶȲ�����ע����������������Ʊ�ԭ����ʵ�鷽����ѧϰ��ע��ʵ������������������


 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д� ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2H2��g��+O2��g��=2H2O��g����H=-483.6kJ/mol | B�� | 2H2��g��+O2��g��=2H2O��l����H=-483.6kJ/mol | ||
| C�� | 2H2��g��+O2��g��=2H2O��g����H=-241.8kJ/mol | D�� | 2H2��g��+O2��g��=2H2O��l����H=-241.8kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
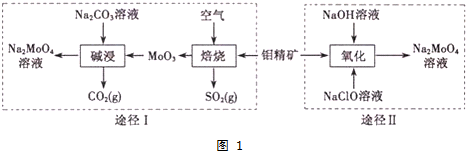

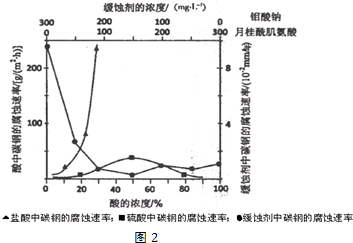
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
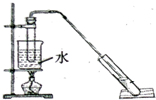 �����dzµ��㡱������Ϊ���ڴ������������������ζ������������ij��ȤС������ˮ�Ҵ��ͱ������Ʊ�����������������ʵ��������£�
�����dzµ��㡱������Ϊ���ڴ������������������ζ������������ij��ȤС������ˮ�Ҵ��ͱ������Ʊ�����������������ʵ��������£�| ���� | �Ҵ� | ���� | �������� |
| ������ | 46 | 60 | 88 |
| �е㣨�棩 | 78.5 | 117.9 | 77.1 |
| �ܶȣ�g/cm3�� | 0.789 | 1.05 | 0.90 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ѹǿ����Ӧ�Ģ�K���䣬��Ӧ�ٺ͢۵�K��С | |
| B�� | 500��ʱ��2NH3��g��+2O2 ��g��?N2O ��g��+3H2O ��g�� K=2.2��1028 | |
| C�� | 500��ʱ��N2 ��g��+O2 ��g��=2NO ��g����H=+181 kJ•mol-1 | |
| D�� | 500��ʱ��2 mol NH3 ��2.5 mol O2��Ϸ�����Ӧ�٣��ɷų�����453.6 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ʵ��� | B�� | ���ʵ���Ũ�� | C�� | �������� | D�� | Ħ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol KClO3���������������1 mol KCl����������� | |
| B�� | KClO3�ֽ����ʿ�����Ҫȡ���ڷ�Ӧ�� | |
| C�� | 1 g KClO3��1 g MnO2��0.1 g Mn2O7��ϼ��ȣ���ַ�Ӧ��MnO2����Ϊ1 g | |
| D�� | ����������������飬�ɼӿ�KClO3�ķֽ����� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com