
| … | E | A | B | ||
| C | … | D |

分析 A、B、C、D、E、F是中学化学中常见的六种短周期元素,A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物,该离子化合物为铵盐,则A为N元素;C单质一般保存在煤油中,则C为Na;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,则F为Al;G单质是日常生活中用量最大的金属,易被腐蚀或损坏,则G为Fe;由元素在周期表中的相对位置可知,E为C元素、B为O元素,D为Cl元素,据此解答.
解答 解:A、B、C、D、E、F是中学化学中常见的六种短周期元素,A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物,该离子化合物为铵盐,则A为N元素;C单质一般保存在煤油中,则C为Na;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,则F为Al;G单质是日常生活中用量最大的金属,易被腐蚀或损坏,则G为Fe;由元素在周期表中的相对位置可知,E为C元素、B为O元素,D为Cl元素,
(1)A为N元素,在元素周期表中位于第二周期第VA族,故答案为:第二周期第VA族;
(2)A与B可组成质量比为7:16的三原子分子为NO2,NO2释放在空气中可能引起的环境问题有酸雨或光化学烟雾等问题,故答案为:酸雨(或光化学烟雾);
(3)N和Na组成的一种离子化合物,能与水反应生成两种碱,该化合物Na3N,该反应的化学方程式是:Na3N+4H2O=3NaOH+NH3•H2O,
故答案为:Na3N+4H2O=3NaOH+NH3•H2O;
(4)同温同压下,将a L 氨气的气体和b L HCl气体通入水中,如果等体积混合NH3和HCl,完全反应生成NH4Cl,溶液呈酸性,若所得溶液的pH=7,则NH3应过量,即a>b,故答案为:>;
(5)Al单质与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)由图可知,1molC(s)与0.5molO2(g)反应得到1molCO(g)放出热量=393.5kJ-283kJ=110.5kJ,该反应热化学方程式为:
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol ①
1molC(s)与1molO2(g)反应得到1molCO2(g)放出热量393.5kJ,该反应热化学方程式为:
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②
根据盖斯定律,①×2-②得:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol,
故答案为:CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol;
(7)若在Cl与Fe组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,则甲为FeCl3,设计如图所示的原电池,正极上Fe3+获得电子生成Fe2+,正极反应式为:Fe3++e-=Fe2+,故答案为:Fe3++e-=Fe2+.
点评 本题考查结构性质位置关系应用,题目比较综合,涉及弱电解质电离、溶液酸碱性计算、溶度积、热化学方程式、原电池等,需要学生具备扎实的基础与迁移运用能力,难度中等.


科目:高中化学 来源: 题型:解答题
 ④癸烷⑤CH3COOH ⑥
④癸烷⑤CH3COOH ⑥ ⑦
⑦ ⑧
⑧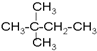 ⑨丙烷
⑨丙烷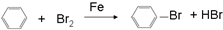 ;
; ;
;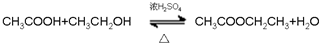 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量NaOH固体时,放在烧杯中且称量较慢 | |
| B. | 定容时,俯视刻度线 | |
| C. | 定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出 | |
| D. | 移液前,容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH在电池的负极上参加反应 | |
| B. | 在外电路中电子由负极沿导线流向正极 | |
| C. | 1 mol乙醇被氧化转移6 mol电子 | |
| D. | 电池正极得电子的物质是O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为某种燃料电池的工作原理示意图,a、b 均为惰性电极.
如图为某种燃料电池的工作原理示意图,a、b 均为惰性电极.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com