
| A、硫酸溶液中加入氢氧化钡溶液 Ba2++SO42-=BaSO4↓ |
| B、钠与水反应 Na+2H2O=Na++2OH-+H2↑ |
| C、碳酸钠溶液中加入足量盐酸 CO32-+2H+=CO2↑+H2O |
| D、铝片与硝酸汞溶液反应 Al+Hg2+=Al 3++Hg |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、H2(g)的燃烧热△H=-285.8 kJ?mol-1 |
| B、1molH2O(l)变成1mo1H2O(g),吸收88kJ能量 |
| C、3H2(g)+CO2(g)=CH3OH(l)+H2O(l)△H=+135.9 kJ?mol-1 |
| D、可以寻找特殊催化剂使H2O分解,同时放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.18 | B、.36 |
| C、34.2 | D、.37.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2、D2、T2互为同位素 |
| B、金属氧化物均为碱性氧化物 |
| C、质量数为131,中子数为78的碘原子常用于核反应堆的燃料棒.其核外电子数为53 |
D、S2-的结构示意图: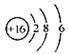 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
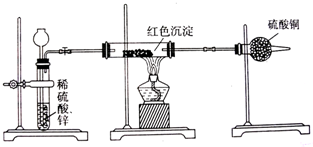
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com