
【题目】CoCl2 6H2O可用作油漆干燥剂,工艺上可用含钴废料(主要为Co,含少量Fe、Al等杂质)为原料来制取CoCl2 6H2O,以下是制备该物质的一种新工艺流程:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.7 | 7.5 | 7.6 | 3.8 |
完全沉淀 | 3.2 | 9.7 | 9.2 | 5.2 |
请回答下列问题:
(1)“酸浸”时Co转化为Co2+,反应的离子方程式为__________。“酸浸”时不能用硝酸的原因是_______。
(2)“氧化”中欲使3 mol的Fe2+为Fe3+,则需要氧化剂过氧化氢的质量至少为_________g。
(3)加入碳酸钠调节pH至a,a的范围是___________。“滤渣”中所含的两种沉淀的化学式为_________。
(4)滤液中加盐酸的目的是_____________________。
(5)操作I为___________________。
(6)以 CoCl26H2O、NH4Cl、H2O2浓氨水为原料可以制备[Co(NH3)6]Cl3的反应方程式为__________。
【答案】 Co+2H+═Co2++H2↑ 减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐 51 5.2≤ɑ<7.6 Fe(OH)3、Al(OH)3 调节溶液的pH,抑制钴离子水解 蒸发浓缩,冷却结晶、过滤、洗涤、干燥 2CoCl26H2O+2NH4Cl+10NH3+H2O2═2[Co(NH3)6]Cl3+14H2O
【解析】试题分析:
(1)“酸浸”时Co与盐酸反应生成氯化钴和氢气。金属与硝酸反应放出NO气体。
(2)根据H2O2 + 2Fe2+ +2H+ = 2Fe3+ +2H2O 计算需要双氧水的质量。
(3)加入碳酸钠调节pH至a,让Fe3+、Al3+完全沉淀,Co2+不能沉淀,判断PH范围。
(4) 盐酸能抑制氯化钴水解。
(5)操作I为从溶液中获得晶体的方法。
(6)根据元素守恒配平 CoCl26H2O、NH4Cl、H2O2浓氨水为原料可以制备[Co(NH3)6]Cl3的方程式。
解析:(1)“酸浸”时Co与盐酸反应生成氯化钴和氢气,方程式为Co+2H+═Co2++H2↑。金属与硝酸反应放出NO气体,为减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐“酸浸”时不能用硝酸。
(2)设需要氧化剂过氧化氢的质量至少为xg
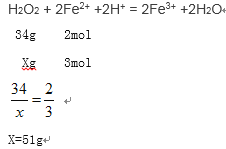
(3)加入碳酸钠调节pH至a,让Fe3+、Al3+完全沉淀PH![]() 5.2,Co2+不能沉淀PH,判断PH<7.6,所以a的范围是5.2≤ɑ<7.6。
5.2,Co2+不能沉淀PH,判断PH<7.6,所以a的范围是5.2≤ɑ<7.6。
(4) 盐酸能抑制氯化钴水解,加入盐酸的目的是调节溶液的pH,抑制钴离子水解。
(5)操作I为蒸发浓缩,冷却结晶、过滤、洗涤、干燥。
(6)根据元素守恒配平 CoCl26H2O、NH4Cl、H2O2浓氨水为原料可以制备[Co(NH3)6]Cl3的方程式为2CoCl26H2O+2NH4Cl+10NH3+H2O2═2[Co(NH3)6]Cl3+14H2O。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】
香豆素是广泛存在于植物中的一类芳香族化合物,大多具有光敏性,有的还具有抗菌和消炎作用,可用于配制香精以及制造日用化妆品和香皂等。它的核心结构是芳香内酯A,其分子式为C9H6O2,该芳香内酯A经下列步骤转变为E和水杨酸。

提示:CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
请回答下列问题:
(1)化合物A中官能团名称为_____________;化合物E的化学名称是________。
(2)B→C的反应方程式为______,该反应类型为_______,该反应步骤的目的是_________________。
(3)化合物D有多种同分异构体,其中一类同分异构体是苯的二取代物,且水解后生成的产物之一能发生银镜反应。这类同分异构体共有________种;写出其中核磁共振氢谱有5种峰,且其信号强度之比为1:1:2:2:2的同分异构体的结构简式__________。
(4)已知R-CH=CH2![]() R-CH2-CH2-Br。请设计合理方案从
R-CH2-CH2-Br。请设计合理方案从 合成
合成 (用反应流程图表示,并注明反应条件)。______
(用反应流程图表示,并注明反应条件)。______
例:由乙醇合成乙烯的反应流程图可表示为
CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]() CH2-CH2
CH2-CH2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重水(D2O)是重要的核工业原料,下列说法错误的是( )
A. 氘(D)原子核外有1个电子 B. 1H与D互称同位素
C. H2O与D2O互称同素异形体 D. 1H218O与D216O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
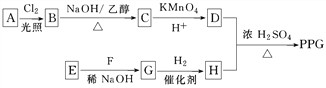
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景。PPG的一种合成路线如下:
已知;
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢
②化合物B为单氯代烃;化合物C的分子式为C5H8
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质
④R1CHO+R2CH2CHO![]()
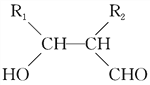
回答下列问题:
(1)A的结构简式为________。
(2)由B生成C的化学方程式为_________________________。
(3)由E和F生成G的反应类型为________,G的化学名称为________。
(4)①由D和H生成PPG的化学方程式为_______________________________________________________;
②若PPG平均相对分子质量为10 000,则其平均聚合度约为________(填标号)。
a.48 b.58
c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有________种(不含立体异构);
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应,
其中核磁共振氢谱显示为3组峰,且峰面积比为6∶1∶1的是________(写结构简式);
D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是________(填标号)。
a.质谱仪 b.红外光谱仪
c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为__________(不写单位,用含c1、ρ1的代数式表示).
(2)物质的量浓度为c1mol·L-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为__________mol·L-1.
(3)将物质的量浓度分别为c2mol·L-1和1/5c2mol·L-1的氨水等质量混合,所得溶液的密度__________(填“大于”、“小于”或“等于”,下同) ρ2 g·cm-3;所得溶液的物质的量浓度__________ 3/5c2mol·L-1(设混合后溶液的体积变化忽略不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卡托普利(E)是用于治疗各种原发性高血压的药物,其合成路线如下:
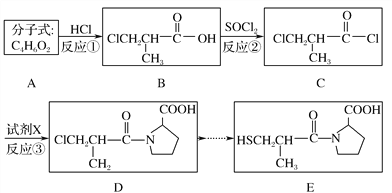
(1)A的系统命名为____________,B中官能团的名称是________,B→C的反应类型是________。
(2)C→D转化的另一产物是HCl,则试剂X的分子式为________。
(3)D在NaOH醇溶液中发生消去反应,经酸化后的产物Y有多种同分异构体,写出同时满足下列条件的物质Y的同分异构体的结构简式:_______________、______________________________。
a.红外光谱显示分子中含有苯环,苯环上有四个取代基且不含甲基
b.核磁共振氢谱显示分子内有6种不同环境的氢原子
c.能与FeCl3溶液发生显色反应
(4)B在氢氧化钠溶液中的水解产物酸化后可以发生聚合反应,写出该反应的化学方程式:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.相对分子质量相同的物质是同种物质
B.分子式相同的不同有机物一定是同分异构体
C.分子组成相差若干个CH2的两种有机物互为同系物
D.符合通式CnH2n+2的不同烃一定互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用合成气(主要成分为CO、CO2和H2)通过下列反应合成甲醇。下列说法正确的是
反应①:CO2(g) + H2(g)![]() CO(g) + H2O(g) △H1=41 kJ·mol–1
CO(g) + H2O(g) △H1=41 kJ·mol–1
反应②:CO(g) + 2H2(g)![]() CH3OH(g) △H2=–99 kJ·mol–1
CH3OH(g) △H2=–99 kJ·mol–1
反应③:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) △H3
CH3OH(g) + H2O(g) △H3
A. 反应①为放热反应 B. 增大反应①的压强,H2转化率提高
C. 反应②使用催化剂,△H2不变 D. △H3=-58 kJ·mol–1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如下:

已知流程中相关金属离子生成氢氧化物沉淀的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 |
(1)“还原”时,应选择_____________(填字母)。
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有_____________(填化学式)。
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10–14。为确保沉锰完全[即溶液中c(Mn2+)<1.0×10–6 mol·L1],应保持溶液中c(S2-)>_____________mol·L-1。
(4)“除铝”时,控制溶液pH的范围为_____________。
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为_____________。
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如下图所示,则最佳的工艺条件是_____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com