
【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol
C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
2C(s)+O2(g)=2CO(g)△H3=-221kJ/mol
若某反应的平衡常数表达式为:K=[c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为____________________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
c(N2O5)/<mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为p0,第2min时体系压强为p1,则p1∶p0=__________。2~5min内用NO2表示的该反应的平均反应速率为__________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__________。(填字母)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)![]() NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为__________(用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200℃、400℃、600℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
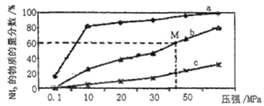
①曲线a对应的温度是__________。
②M点对应的H2的转化率是__________。
(5)工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:______________________________________________。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2,Ka2=6.3×10-8。)
【答案】 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ·mol-1 7∶4(或1.75∶1) 0.22mol·L-1·min-1 b k正/k逆 200℃ 75% 显碱性,因为Kb(NH3·H2O)>Ka2(H2SO3),所以SO32-水解程度大(或其他合理解释)
【解析】(1)若某反应的平衡常数表达式为:K=[c(N2)·c2(CO2)]/[c2(NO)·c2(CO)],该反应为2NO(g)+2CO(g)N2(g)+2CO2(g),①N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol②C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol③2C(s)+O2(g)=2CO(g)△H3=-221kJ/mol由盖斯定律计算②×2③①得到2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ·mol-1,故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ·mol-1
(2)① 2N2O5(g)![]() 4NO2(g)+O2(g)
4NO2(g)+O2(g)
开始(mol/L) 1.0000
反应(mol/L) 0.5 1 0.25
2min(mol/L) 0.5 10.25
反应前后气体的压强之比等于其物质的量之比,所以p:p0=(0.5+1+0.25)mol:1.00mol=7:4(或1.75),2~5min内用NO2表示的该反应的平均反应速率为v(NO2)=![]() =0.22mol·L-1·min-1②a.NO2和O2的浓度比始终保持不变,不能确定反应是否达到化学平衡状态,故a错误;b.该反应是气体体积增大的反应,容器中的压强不断的发生变化,当容器中压强不再变化,反应已达到化学平衡状态,故b正确;c.υ正(NO2)=2υ逆(N2O5)才表明达到化学平衡状态,故c错误;d.在恒容的条件下,该反应 气体的密度始终保持不变,不能确定反应是否达到化学平衡状态,故d错误。答案为:①7∶4(或1.75∶1) 、 0.22mol·L-1·min-1 ②b
=0.22mol·L-1·min-1②a.NO2和O2的浓度比始终保持不变,不能确定反应是否达到化学平衡状态,故a错误;b.该反应是气体体积增大的反应,容器中的压强不断的发生变化,当容器中压强不再变化,反应已达到化学平衡状态,故b正确;c.υ正(NO2)=2υ逆(N2O5)才表明达到化学平衡状态,故c错误;d.在恒容的条件下,该反应 气体的密度始终保持不变,不能确定反应是否达到化学平衡状态,故d错误。答案为:①7∶4(或1.75∶1) 、 0.22mol·L-1·min-1 ②b
(3)平衡时正逆反应速率相等,由正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),联立可得Kp= k正/k逆,答案为; k正/k逆
(4) ①合成氨反应放热,温度越低氨气的百分含量越高,所以,曲线a对应的温度是200℃
②3N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
反应前(mol)1 30
反应了(mol)x3x2x
平衡时(mol)1x33x2x
据题意M点时:![]() =60% x=
=60% x=![]() ,则氢气的转化率为
,则氢气的转化率为![]() 答案为:①200℃②
答案为:①200℃②![]()
(5)铵根离子水解使溶液显酸性,亚硫酸根离子水解使溶液显碱性,铵根离子水解得到氨水,亚硫酸根离子水解得到亚硫酸氢根离子,亚硫酸根离子是H2SO3的第二步电离,由于K(NH3·H2O)>Ka1,说明氨水比亚硫酸氢根离子的电离能力强,根据越弱越水解,铵根离子的水解程度小于亚硫酸根离子的水解程度,故溶液显碱性;答案为:显碱性,因为Kb(NH3·H2O)>Ka2(H2SO3),所以SO32-水解程度大


科目:高中化学 来源: 题型:
【题目】药物W对肝癌的治疗具有很好的效果,一种合成药物W的路线如下:
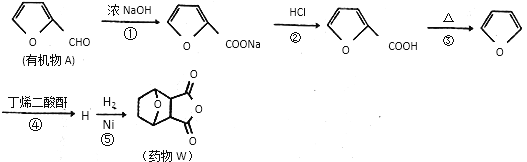
已知以下信息:
①2HCHO+NaOH→CH3OH+HCOONa
②![]()
③丁烯二酸酐的结构筒式为![]()
回答下列问题:
(1)有机物A中含有的官能团有碳碳双键、________(填名称)。
(2)第①步反应中除生成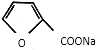 外,还生成另一产物,此产物的结构简式为________。
外,还生成另一产物,此产物的结构简式为________。
(3)H的结构简式为___________。
(4)第⑤步的反应类型是____________。
(5)L是药物W的同分异构体,同时满足下列条件的L有_____种(不考虑立体异构);
①分子中含有苯环,苯环上有4个取代基
②既能与FeCl3溶液发生显色反应,又能与NaHCO3溶液反应生成气体
③1mol L能与3molNaOH完全反应
其中核磁共振氢谱为四组峰,峰面积比为1:2:2:3的结构简式为_________。
(6)写出由![]() 制备丁烯二酸酐
制备丁烯二酸酐![]() 的合成路线:___________(其他试剂任选)。
的合成路线:___________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氯水的成分复杂,但饱和氯水久置后,成分发生变化,下列粒子①Cl2;②H2O;③Cl-;④HClO;⑤ H+,因饱和氯水久置而减少的是
A. ①②③ B. ①④ C. ②④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈酸性的是
A. pH<7的溶液 B. c(H+)>c(OH—) 的溶液
C. pH>7的溶液 D. c(H+)<c(OH—) 的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是在实验室进行二氧化硫制备与性质实验的组合装置,回到下列问题:
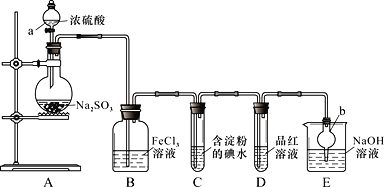
(1)仪器名称:a_____,b_____。装置A中制取SO2时不能用稀H2SO4代替浓H2SO4,原因是________________________。
(2)为了验证B中发生了氧化还原反应,应向B中加入下列试剂中的______(填序号)。
①KMnO4溶液 ②稀盐酸酸化的BaCl2溶液 ③NaOH溶液 ④KSCN溶液
能说明I-还原性弱于SO2的现象为________;发生反应的离子方程式是_______。
(3)要验证SO2与品红反应的产物不稳定,实验操作方法及现象是_______________。实验中的尾气用NaOH溶液吸收,反应的离子方程式是_______________。
(4)铜与浓硫酸在加热条件下反应也可制SO2,该反应体现了浓H2SO4的哪些性质?________,反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,p、q、m、n分别为常见的气体单质,p和s均为有色气体,q能在p中燃烧并产生苍白色火焰,v的水溶液呈碱性,t的水溶液呈酸性。回答下列问题:
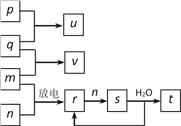
(1)新制p的水溶液中,除H2O、H+、OH-外,还含有____________等粒子(填化学式),该溶液中发生反应的离子方程式是___________。
(2)取2份新制p的水溶液,向第一份中滴入紫色石蕊溶液,现象是____________;第二份先滴入FeCl2溶液,后加入KSCN溶液,其现象是_____________,有关反应的离子方程式为_______________、_________________。
(3)反应“v+n→r”的化学方程式是__________,每转移2 mol电子,可生成标准状况下的r气体________L。s溶于水的反应中,氧化剂与还原剂的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三种溶液,可能是KCl、NaBr、KI.向甲中加入淀粉溶液和氯水,溶液变为橙色,再加入丙,颜色无明显变化,则甲、乙、丙依次含有( )
A.NaBr、KCl、KI
B.NaBr、KI、KCl
C.KI、NaBr、KCl
D.KCl、KI、NaBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。
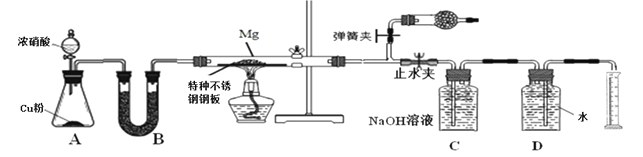
(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红综色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________;③______________________________。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com