
【题目】已知下列物质在20℃下的Ksp如下,
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 | 2.0×10-48 | 2.0×10-12 |
下列说法不正确的是
A. 20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是:Ag2CrO4>AgCl>AgBr>AgI>Ag2S。
B. 向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br -) /(Cl -)=2.7×10-3
C. 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是K2CrO4
D. 某溶液中含有Cl-、Br-和I-,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,Cl-最先沉淀出来
【答案】D
【解析】
A.20℃时,在AgCl的饱和溶液中,Ksp=c(Ag+)×c(Cl-)=2.0×10-10,c(Ag+)= ![]() mol·L-1;Ag2CrO4饱和溶液中,Ksp=c2(Ag+)c(CrO42-)=2.0×10-12,c(Ag+)=
mol·L-1;Ag2CrO4饱和溶液中,Ksp=c2(Ag+)c(CrO42-)=2.0×10-12,c(Ag+)=![]() mol·L-1;同理,在AgI 的饱和溶液中,c(Ag+)=
mol·L-1;同理,在AgI 的饱和溶液中,c(Ag+)= ![]() mol·L-1;在AgBr的饱和溶液中,c(Ag+)=
mol·L-1;在AgBr的饱和溶液中,c(Ag+)=![]() mol/L;在Ag2S 的饱和溶液中,c(Ag+)=
mol/L;在Ag2S 的饱和溶液中,c(Ag+)=![]() mol·L-1;故Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl>AgBr>AgI>Ag2S,故A正确;
mol·L-1;故Ag+物质的量浓度由大到小的顺序是Ag2CrO4>AgCl>AgBr>AgI>Ag2S,故A正确;
B.当两种沉淀共存时,Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=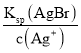 ,c(Cl-)=
,c(Cl-)=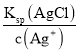 ,则
,则![]() =
=![]() =2.7×10-3,故B正确;
=2.7×10-3,故B正确;
C.指示剂的作用是指示出氯离子恰好沉淀完全,即让氯离子先沉淀,沉淀完全后,再滴入硝酸银溶液会生成一种颜色不同的沉淀来指示滴定终点;氯化银、溴化银、碘化银的组成都是1∶1,依据Ksp可以直接比较溶解度大小为氯化银>溴化银>碘化银;Ksp(AgCl)= c(Ag+)×c(Cl-)=2.0×10--10,c(Cl-)=![]() mol·L-1;Ksp(Ag2CrO4)= c2(Ag+)c(CrO42-)=2.0×10-12,c(CrO42-)=
mol·L-1;Ksp(Ag2CrO4)= c2(Ag+)c(CrO42-)=2.0×10-12,c(CrO42-)= ![]() mol·L-1,同理硫化银的Ksp= c2(Ag+)c(S2-)=2.0×10-48,c(S2-)=
mol·L-1,同理硫化银的Ksp= c2(Ag+)c(S2-)=2.0×10-48,c(S2-)=![]() mol·L-1,说明铬酸银溶解度大于氯化银,硫化银溶解度小于氯化银,则加入K2CrO4做指示剂,可正确的测定氯化物的含量,故C正确;
mol·L-1,说明铬酸银溶解度大于氯化银,硫化银溶解度小于氯化银,则加入K2CrO4做指示剂,可正确的测定氯化物的含量,故C正确;
D.某溶液中含有Cl-、Br-和I-,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,氯化银、溴化银、碘化银的组成都是1∶1,Ksp由大到小的顺序为:AgCl>AgBr>AgI,因此I-最先沉淀出来,故D错误;
答案选D。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】已知:4FeO42﹣+10H2O═4Fe(OH)3↓+8OH﹣+3O2↑,测得c(FeO42﹣)在不同条件下变化如图甲、乙、丙、丁所示:
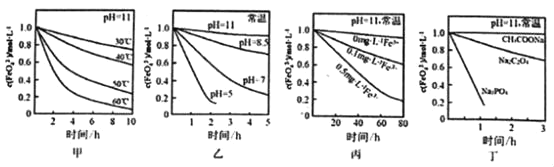
下列说法正确的是( )
A.图甲表明,其他条件相同时,温度越低FeO42﹣转化速率越快
B.图乙表明,其他条件相同时,碱性越强FeO42﹣转化速率越快
C.图丙表明,其他条件相同时,碱性条件下Fe3+能加快FeO42﹣的转化
D.图丁表明,其他条件相同时,钠盐都是FeO42﹣优良的稳定剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙醇为主要原料合成一种具有果香味的物质 C 和化合物 D 的合成路线如图所示。
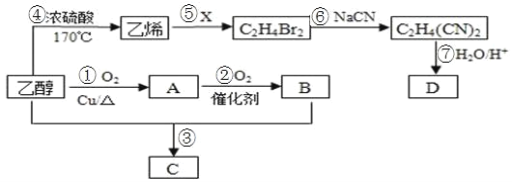
请回答下列问题:
(1)B的结构简式为_______。
(2)反应⑤的化学方程式为_______;B分子中的官能团名称为_______;反应⑥的类型为________。
(3)为了探究反应③的反应原理,通常采用“同位素示踪法”的方法,请结构简式为 CH3CH218OH,书写化反应③学方程式为_______。
(4)已知D的相对分子量为 118,其中碳、氢两元素的质量分数分别为 40.68%、5.08%,其余为氧元素,则 D 的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是
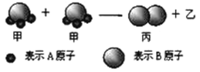
A.1个乙分子中含有2个A原子
B.该反应类型是分解反应
C.相对分子质量:Mr(甲)=Mr(乙)+Mr(丙)
D.该反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。利用生物发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如下图所示:

已知:反应I和反应II的平衡常数随温度变化曲线如图所示。
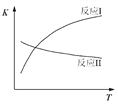
(1)反应I中,1 mol CH3CH2OH(g)参与反应后的热量变化是256 kJ。
① H2O的电子式是:_________________。
② 反应I的热化学方程式是:___________________________。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO的平衡转化率见下图(各点对应的反应温度可能相同,也可能不同)。
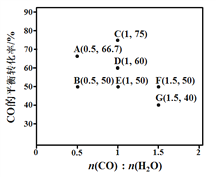
① 图中D、E两点对应的反应温度分别为TD和TE。判断:TD_______TE(填“<” “=”或“>”)。
② 经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的____相同。
③ 当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是______。
(3)反应III,在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如下图所示。
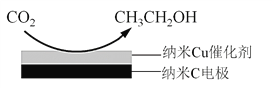
① 阴极的电极反应式是__________________________。
② 从电解后溶液中分离出乙醇的操作方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:I- >Fe2+>Br-,向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如图所示。下列说法中正确的是
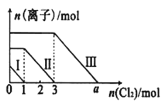
A.a值等于6
B.线段Ⅰ代表Br-的变化情况
C.线段Ⅲ代表Fe2+的变化情况
D.原混合溶液中n(FeBr2)=4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
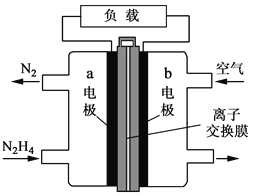
A. b极发生氧化反应
B. a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电流从a极经过负载流向b极
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为___________________。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为______________。
(3)NH3的沸点比PH3高,原因是___________;PO43-离子的立体构型为___________。
(4)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为______________。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因_____________________。
(6)磷的一种单质白磷(P4)属于分子晶体,其晶胞结构如下图。已知最近两个白磷分子间的距离为 a pm(1pm=10-12m),阿伏加德罗常数的值为NA,则该晶体的密度为__________________g/cm3(只要求列算式,不必计算)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构与性质之间有密切的关系。请回答下列问题:
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于________晶体;Ni原子和C原子之间存在________键。
(2)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③HCHO等,这些分子中C原子为sp2杂化的有________(填物质序号)。
(3)已知苯酚(![]() )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子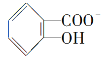 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是_____________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com