
某溶液,只可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、NO2-、CO32-、NO3-,现取两份100mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有5.84g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.1g; ②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀1.0g,该沉淀能溶于稀盐酸产生无色气体;③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用50mL0.5mol·L-1的硫酸溶液恰好完全吸收,酸也不剩余。根据上述实验,以下推测不正确的是( )
| A.原溶液一定不存在较大浓度的H+、Mg2+ |
| B.原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5︰2︰1 |
| C.不能确定原溶液是否含有K+、NO3- |
| D.实验中产生的棕色气体遇空气颜色会加深 |
C
解析试题分析:第一份加足量AgNO3溶液后,有5.84g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.1g,这说明该白色沉淀中一定含有亚硝酸银,亚硝酸银与盐酸反应生成氯化银与亚硝酸,亚硝酸不稳定分解生成NO、NO2和水。所以原溶液中一定含有NO2-,则氢离子一定不能大量共存。将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀1.0g,该沉淀能溶于稀盐酸产生无色气体,则该白色沉淀应该是碳酸钙,物质的量是0.01mol,所以气体中含有CO2,这说明反应①中生成的白色沉淀一定有碳酸银,则原溶液中一定含有CO32-。因此Mg2+就一定不能大量共存。根据碳原子守恒,CO32-的物质的量是0.01mol。5.84g沉淀中亚硝酸银沉淀的质量=5.84g-0.01mol×276g/mol=3.08g,因此亚硝酸银的物质的量=3.08g÷154g/mol=0.02mol,则原溶液中NO2-的物质的量是0.02mol。第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,该气体一定是氨气,因此原溶液中含有NH4+。用50mL0.5mol/L的硫酸溶液恰好完全吸收,酸也不剩余,硫酸的物质的量是0.025mol,则氨气的物质的量是0.025mol×2=0.05mol,则原溶液中NH4+的物质的量是0.05mol,所以原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5︰2︰1,因此选项A、B正确。根据电荷守恒可知,原溶液中一定还含有NO3-,但K+不能确定,C不正确;实验中产生的棕色气体中含有NO,遇空气生成红棕色NO2,所以颜色会加深,D正确,答案选C。
考点:考查考查离子共存、离子检验的有关判断


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:单选题
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
| A.Na+、K+、Cl-、SO42- | B.Na+、Cu2+、SO42-、NO3- |
| C.Mg2+、NH4+、SO42-、Cl- | D.K+、Ba2+、MnO4-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
能大量共存于同一溶液中,且当改变条件使水电离的c(H+)=10-13mol/L时,一定能发生反应的离子组是
| A.S2-、Na+、SO32-、Cl- | B.Ca2+、NH 、SO 、SO 、SiO32- 、SiO32- |
C.Na+、Ba2+、Cl-、HSO | D.Al3+、Na+、SO 、NO 、NO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列表示对应化学反应的离子方程式正确的是( )
A.明矾溶液中滴加过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH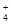 |
| B.醋酸溶液与Mg(OH)2反应:Mg(OH)2+2H+===Mg2++2H2O |
C.小苏打溶液中加足量澄清石灰水:2HCO +Ca2++2OH-===CaCO3↓+2H2O+CO +Ca2++2OH-===CaCO3↓+2H2O+CO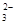 |
D.SO2通入FeCl3溶液中:SO2+Fe3++2H2O===SO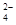 +Fe2++4H+ +Fe2++4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中K+、Fe2+、C6H5OH、Br-可以大量共存 |
B.和KI溶液反应的离子方程式:Fe3++2I- Fe2++I2 Fe2++I2 |
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42—+Ba2++3OH- Fe(OH)3+ BaSO4 Fe(OH)3+ BaSO4 |
| D.1 L0.1 mol·L—1该溶液和足量的Zn充分反应,生成11.2 g Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.二氧化硫具有较强的还原性,故不能用浓硫酸干燥 |
| B.含极性键的共价化合物一定是电解质 |
| C.氯化钠、冰醋酸、酒精分别属于强电解质、弱电解质、非电解质 |
| D.天然气、酒精和液化石油气分别属于化石能源、不可再生能源和二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子反应方程式能正确表达相关反应的是
| A.在FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| B.用石墨电极电解氯化镁溶液:2Cl-+2H2O电解Cl2↑+H2↑+2OH- |
| C.向CaCl2溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+ |
| D.等物质的量浓度的小苏打溶液和石灰水按体积比3:2混合: |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式表达正确的是
| A.碘化亚铁溶液中通入少量氯气:Cl2+2Fe2+=2Fe3++2Cl— |
| B.向1mol/L 0.1L的明矾溶液中加入0.5mol/L 0.2L的Ba(OH)2溶液: 2Al3++3SO42—+ 3Ba2++6OH—=2Al(OH)3↓+3BaSO4↓ |
| C.将蛋壳浸泡到醋酸中:CO32—+2CH3COOH=2CH3COO—+ CO2↑+H2O |
| D.将过氧化钠与水反应:2O22—+2H2O=O2+4OH— |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,下列各组离子在指定的溶液中可能大量共存的是
| A.无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- |
| B.含大量Fe3+的溶液中:K+、I-、SO42-、NO3- |
| C.与Al反应放出H2的溶液中:NH4+、Na+、NO3-、F- |
| D.由水电离出的c(H+)=1.0×10-14 mol·L-1的溶液中:Mg2+、K+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com