
已知热化学方程式:SO2(g)+O2(g)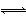 SO3(g) ΔH=-98.32 kJ·mol-1,在容器中充入2 mol SO2和1 mol O2,充分反应,最终放出的热量( )
SO3(g) ΔH=-98.32 kJ·mol-1,在容器中充入2 mol SO2和1 mol O2,充分反应,最终放出的热量( )
A.=196.64 kJB.=98.32 kJ C.<196.64 kJD.>196.64 kJ
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源:2015届安徽省同步课时练(人教选修4)1.2 燃烧热能源试卷(解析版) 题型:填空题
按要求完成下列问题:
(1)在1.01×105 Pa时,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则H2的燃烧热的ΔH= ;表示氢气燃烧的热化学方程式为 。
(2)在1.01×105 Pa时,16 g S在足量的氧气中充分燃烧生成二氧化硫,放出148.5 kJ的热量,则S的燃烧热的ΔH= ;S燃烧的热化学方程式为 。
(3)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水。已知室温下1 g甲硅烷自燃放出44.6 kJ热量,其热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)4.1原电池试卷(解析版) 题型:选择题
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是( )
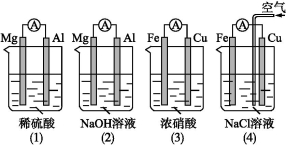
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为6H2O+6e- 6OH-+3H2↑
6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e- Fe2+
Fe2+
D.(4)中Cu作正极,电极反应式为2H++2e- H2↑
H2↑
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)2.1 化学反应速率试卷(解析版) 题型:选择题
在容积为2 L的密闭容器中充入2 mol SO2和一定量O2,发生反应2SO2+O2 2SO3,当反应进行到4 min时,测得n(SO2)=0.4 mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
2SO3,当反应进行到4 min时,测得n(SO2)=0.4 mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
A.等于1.6 mol
B.等于1.2 mol
C.大于1.6 mol
D.小于1.2 mol
查看答案和解析>>
科目:高中化学 来源:2015届安徽望江中学同步课时练(人教选修4)2.1 化学反应速率试卷(解析版) 题型:选择题
下列说法正确的是( )
A.化学反应速率通常用单位时间内反应物或生成物的质量变化来表示
B.用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比
C.化学反应速率的单位由浓度单位决定
D.在反应过程中,反应物的浓度逐渐变小,所以用反应物表示的化学反应速率为负值
查看答案和解析>>
科目:高中化学 来源:2015届安徽师大附中高二下学期期中考查化学试卷(解析版) 题型:填空题
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)请回答下列问题:
W (s) + 3H2O (g)请回答下列问题:
(1)上述反应的化学平衡常数表达式为 。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为3:5,则H2的平衡转化率 。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
主要成份 | WO3 W2O5 WO2 W |
500℃时,固体物质的主要成分为 ;
第二阶段反应的化学方程式为 ;
假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) 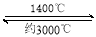 WI4 (g)。下列说法正确的有 。
WI4 (g)。下列说法正确的有 。
A.灯管内的I2可循环使用
B.WI4在灯管壁上分解,使灯管的寿命延长
C.WI4在灯丝上分解,产生的W又沉积在灯丝上
D.接通电源后,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
科目:高中化学 来源:2015届安徽师大附中高二下学期期中考查化学试卷(解析版) 题型:选择题
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的少
D.容器Ⅰ、Ⅲ中反应的平衡常数相同
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三上学期第一次月考理综试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+的3d轨道中有9个电子。
请回答下列问题:
(1)Y基态原子的电子排布式是________;X基态原子的电子排布图是
Z所在周期中第一电离能最大的主族元素是________(写出元素名称)。R原子结构示意图为 。
(2)XY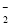 的立体构型是________;R2+的水合离子中,
的立体构型是________;R2+的水合离子中,
提供孤电子对的原子是________(写出元素符号)。
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是________。

(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是____________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都市高新区高三9月月考化学试卷(解析版) 题型:选择题
下列各组离子在相应的条件下一定能大量共存的是
A.在碱性溶液中:HCO3-、K+、C1-、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3-、K+、Na+、SO42-
C.在c(H+)/c(OH-)==1×1013的溶液中:NH4+、Br-、C1-、K+
D.通有SO2的溶液中: Ca2+、C1-、NO3-、A13+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com