
分析 (1)由Ba2++SO42-=BaSO4↓可知n(Ba2+)=n(BaSO4),由钡离子守恒可知n[Ba(OH)2]=n(Ba2+),据此计算氢氧化钡的物质的量;
(2)反应后测得溶液的pH=13,OH-剩余,设NaOH的物质的量浓度为x,则$\frac{0.2x+2n[Ba(OH)_{2}]-0.1L×0.3mol/L×2}{0.3L}$=0.1mol/L,以此计算.
解答 解:(1)充分反应,得沉淀4.66g,n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,由Ba2++SO42-=BaSO4↓可知n(Ba2+)=n(BaSO4),由钡离子守恒可知n[Ba(OH)2]=n(Ba2+)=0.02mol,
故答案为:0.02;
(2)反应后测得溶液的pH=13,OH-剩余,设NaOH的物质的量浓度为x,则$\frac{0.2x+2n[Ba(OH)_{2}]-0.1L×0.3mol/L×2}{0.3L}$=0.1mol/L,n[Ba(OH)2]=0.02mol,解得x=0.25mol/L,故答案为:0.25.
点评 本题考查酸碱混合的计算,为高频考点,把握发生的离子反应、pH的计算等为解答的关键,侧重分析与计算能力的考查,注意反应后碱过量,题目难度不大.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学键主要包括离子键、共价键和氢键等 | |
| B. | 离子键是阴、阳离子通过静电作用而形成的化学键 | |
| C. | 任何离子键在形成过程中必定有电子的得与失 | |
| D. | 非金属元素的原子之间不可能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
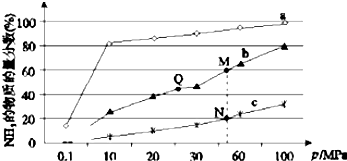
| A. | 上图中M、N、Q点平衡常数K 的大小关系为K(M)=K(Q)>K(N) | |
| B. | 加催化剂能加快反应速率但H2的平衡转化率不变 | |
| C. | 相同压强条件下,投料相同,达到平衡所需时间关系为a>b>c | |
| D. | 由曲线a可知,当压强增加到10OMPa以上,NH3的物质的量分数可达到100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
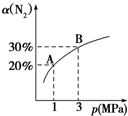 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )| A. | 平衡状态由A变到B时,平衡常数K(A)=K(B) | |
| B. | 将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ | |
| C. | 升高温度,逆反应速率增大,正反应速率减小 | |
| D. | 上述反应达到平衡后,增大H2浓度,平衡正向移动,H2转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于2amol•L-1 | B. | 等于2amol•L-1 | C. | 小于2amol•L-1 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
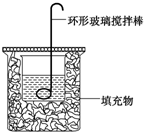 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com