
| A. | 大于2amol•L-1 | B. | 等于2amol•L-1 | C. | 小于2amol•L-1 | D. | 无法判断 |
分析 硫酸浓度越大,硫酸的密度越大,设出49%、98%的硫酸的密度,然后根据c=$\frac{1000ρω}{M}$列式计算即可.
解答 解:设98%的硫酸的浓度为c,49%的硫酸溶液密度为x,98%的硫酸溶液密度为y,则x<y,
根据c=$\frac{1000ρω}{M}$可知:$\frac{a}{c}$=$\frac{49%x}{98%y}$,
整理可得:c=$\frac{98%ay}{49%x}$=2a×$\frac{y}{x}$mol/L,由于x<y,则$\frac{y}{x}$>1,
所以98%硫酸溶液的浓度c>2amol/L,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确硫酸密度与质量分数的关系为解答关键,注意掌握物质的量浓度与溶质质量分数的关系,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++Cu=2Fe2++Cu 2+ | B. | Cu2++H2S=CuS↓+2H+ | ||
| C. | Cl2+2I-=2Cl-+I2 | D. | Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显血红色,该溶液中一定含有Fe2+ | |
| B. | 用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2 | |
| C. | 检验Fe(NO3)2是否已氧化变质,可将Fe(NO3)2溶于稀H2SO4后滴加KSCN溶液,再观察溶液是否变血红 | |
| D. | 向某溶液中加NaOH溶液产生红褐色沉淀,说明溶液中含有Fe3+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与B具有相同的电子层数 | |
| B. | A的金属活动性顺序排在Zn之后 | |
| C. | A与B能生成A2B3型固态化合物 | |
| D. | A元素的单质与B元素单质反应时,每消耗9 g A的同时消耗16g B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
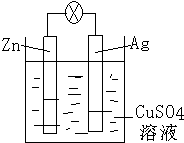 (1)燃料电池是一种高效、环境友好的发电装置.氢氧燃料电池已用于航天飞机.以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为2H2+4OH--4e-═4H2O,这种电池在放电使用一段时间后,电解质溶液中的c(OH-)将减小(填“增大”“减小”或“不变”).
(1)燃料电池是一种高效、环境友好的发电装置.氢氧燃料电池已用于航天飞机.以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为2H2+4OH--4e-═4H2O,这种电池在放电使用一段时间后,电解质溶液中的c(OH-)将减小(填“增大”“减小”或“不变”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com