
【题目】(1)已知水的比热容为4.18×10-3 kJg-1℃-1.10g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500g H2O的温度由18℃升至62.4℃,则硫黄的燃烧热为__,热化学方程式为_.
(2)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下:
2P(s)+3Cl2(g)=2PCl3(g)△H=﹣612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g)△H=﹣798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为___.
(3)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
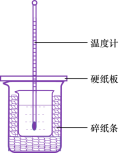
①从实验装置上看,图中尚缺少的一种玻璃用品是____.
②烧杯间填满碎纸条的作用是_.
③大烧杯上如不盖硬纸板,求得的中和热数值_(填“偏大、偏小、无影响”).
④如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热_(填“相等、不相等”).
⑤用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会__;(填“偏大”、“偏小”、“无影响”).
【答案】296.9kJmol-1 S(s)+O2(g)=SO2(g)△H=-296.9kJmol-1 PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ/mol 环形玻璃搅拌棒 保温、隔热,减少实验过程中的热量损失 偏小 不相等 相等 偏小
【解析】
(1)10g硫磺即物质的量![]() ,燃烧共放出热量为:Q=mc(t2t1)=500g×4.18×103 kJ(g℃)1×(62.418)℃=92.796 kJ,则1mol(32g)硫磺燃烧放出的热量为:92.796kJ÷0.3125=296.9kJ,所以硫磺的燃烧热为296.9kJmol1,热化学方程式为
,燃烧共放出热量为:Q=mc(t2t1)=500g×4.18×103 kJ(g℃)1×(62.418)℃=92.796 kJ,则1mol(32g)硫磺燃烧放出的热量为:92.796kJ÷0.3125=296.9kJ,所以硫磺的燃烧热为296.9kJmol1,热化学方程式为![]() ;
;
(2)根据盖斯定律,可以得出气态PCl5生成气态PCl3和Cl2的热化学方程式为:PCl5(g)=PCl3(g)+Cl2(g)△H=+93kJ/mol;
(3)①根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
②中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:保温、隔热,减少实验过程中的热量损失;
③大烧杯上如不盖硬纸板,会有部分热量散失,故中和热数值偏小;
④用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,参与反应的酸碱量更多,所放出的热量更多,故与上述实验相比,放出的热量更多;反应物不变,均是盐酸和氢氧化钠,故中和热不变;
⑤一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替NaOH溶液反应,反应放出的热量偏小,故答案为:偏小。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
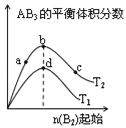
A. 图中T2一定大于T1
B. 图中b点速率一定大于d点速率
C. 达到平衡时,A2的转化率大小为:c>b>a
D. 加入催化剂可以使状态d变为状态b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。
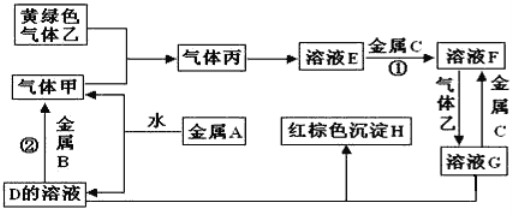
请根据以上信息回答下列问题
(1)写出下列物质的化学式:A__;H ___; G____;乙___。
(2)写出下列反应的化学方程式:
反应①_______;
反应②________。
(3)检测溶液G中金属离子的常用方法是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)![]() N2(g)+CO2(g)△H=-373.2kJ/mo1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+CO2(g)△H=-373.2kJ/mo1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入NOD.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.Fe2O3(s) ![]() Fe(s)
Fe(s)![]() FeCl2 (s)
FeCl2 (s)
B.Cu2S(s) ![]() Cu(s)
Cu(s) ![]() CuSO4 (aq)
CuSO4 (aq)
C.Al(s)![]() NaAlO2 (aq)
NaAlO2 (aq) ![]() Al(OH)3(s)
Al(OH)3(s)
D.NaCl(aq) ![]() NaHCO3 (s)
NaHCO3 (s) ![]() Na2CO3 (s)
Na2CO3 (s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蓝色钾盐水合物KaCub(C2O4)c·H2O(铜元素为+2价)的组成可通过下列实验确定:
步骤①:称取一定质量的样品置于锥形瓶中,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.0200 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液12.00 mL(![]() 的还原产物为Mn2+)。
的还原产物为Mn2+)。
步骤②:充分加热滴定后的溶液,冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI,发生反应2Cu2++4I-=2CuI↓+I2
步骤③:加入少量淀粉溶液作指示剂,用0.0200 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液15.00 mL,发生反应I2+2![]() =2I-+
=2I-+![]()
(1)若步骤②中未对滴定后的溶液进行加热,则测出的Cu2+的物质的量将____(填“偏大”、“偏小” 或“不变”) 。
(2)步骤③中滴定终点的现象是___________。
(3)通过计算确定a:b:c=___________。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新冠肺炎疫情期间,多种含氯消毒剂如84消毒液、Cl2、NaClO2等对病毒均具有很好的消杀作用,其中亚氯酸钠(NaClO2)在工业上常以ClO2气体为原料制备,实验室制备亚氯酸钠的装置如图所示(夹持装置已略)。
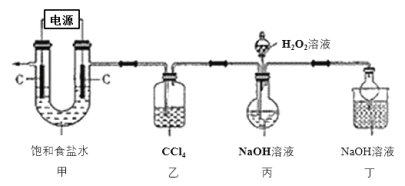
已知:①控制电压电解饱和食盐水可得到ClO2;
②Cl2易溶于CCl4;
③亚氯酸钠在不同温度下的溶解度如下表所示:
温度℃ | 20 | 40 | 60 |
溶解度/g | 6.2 | 23.4 | 48.3 |
回答下列问题:
(1)装置甲中产生ClO2的电极反应式为_____________________。
(2)装置乙中CCl4的作用为________________________________。
(3)装置丙中生成NaClO2的化学方程式为____________________________。
(4)从装置丙反应后的溶液中获得NaClO2晶体的步骤如下:
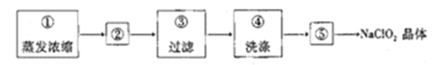
其中步骤①加热到_________________(填现象)时停止加热,步骤②是__________________。
(5)准确称取2.26gNaClO2粗品,加入盛有20.00mL刚煮沸并冷却过的水、足量10%的稀硫酸和30.00mL质量分数为40%的KI溶液(足量)的碘量瓶中,立即密封并摇晃碘量瓶至试样完全反应,再加入淀粉作指示剂用浓度为3.00mol/L的Na2S2O3溶液滴定(已知整个过程中发生的反应依次为![]() +4I-+4H+=2I2+Cl-+2H2O,
+4I-+4H+=2I2+Cl-+2H2O,![]() ),
),
①若三次平行实验测得消耗的Na2S2O3溶液的平均体积为30.00mL,则粗品的纯度为_________________%(保留三位有效数字),
②若使用的水未煮沸,则测定结果会___________________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下物质:①HF、②Cl2、③H2O、④N2、⑤C2H4、⑥C2H6、⑦H2、⑧H2O2和⑨HCN。
(1)只含有σ键的是__________(填序号,下同);
(2)既含有σ键又含有π键的是__________。
(3)含有由两个原子的s轨道重叠形成σ键的是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com