
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.Fe2O3(s) ![]() Fe(s)
Fe(s)![]() FeCl2 (s)
FeCl2 (s)
B.Cu2S(s) ![]() Cu(s)
Cu(s) ![]() CuSO4 (aq)
CuSO4 (aq)
C.Al(s)![]() NaAlO2 (aq)
NaAlO2 (aq) ![]() Al(OH)3(s)
Al(OH)3(s)
D.NaCl(aq) ![]() NaHCO3 (s)
NaHCO3 (s) ![]() Na2CO3 (s)
Na2CO3 (s)
科目:高中化学 来源: 题型:
【题目】草酸(HOOC-COOH)是一种常见的有机酸,利用淀粉制备草酸的实验流程如图:
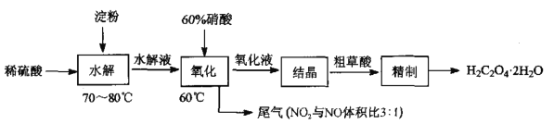
回答下列问题:
(1)“水解”时,检验淀粉是否水解完全,所用的试剂是____;“水解”及“氧化”步骤中适宜的加热方式是________________。
(2)“氧化”时实验装置如图所示(夹持及加热装置已略):
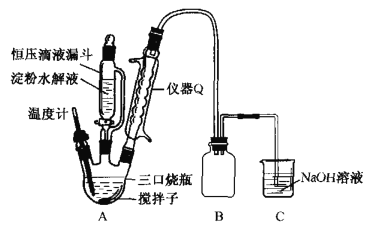
①仪器Q的名称是________.
②三口烧瓶中生成H2C2O4· 2H2O的化学方程式为____________。
③装置B的作用是___________,装置C的作用是_______________。
(3)已知在20℃、70℃时,草酸的溶解度依次为为9. 5 g/(l00g水),84.5g/(l00g水),则粗草酸“精制”需采用的提纯方法为___________________。
(4)探究H2C2O4的性质:
①向NaHCO3溶液中加入草酸溶液,产生大量气体,可得出草酸的酸性比碳酸_____(填“强”或“弱”)。
②向草酸中加入足量C2H5OH和适量浓硫酸加热,产生有芳香气味的油状物。该生成物为___________(写结构简式)。
③向K2Cr2O7溶液中加入H2C2 O4·2H2O析出K[Cr(C2O4)2(H2O)2]晶体,该反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物A、B、C互为同分异构体,分子式为C5H8O2,有关的转化关系如下图所示,已知A的碳链无支链,且1molA能与4molAg[(NH3)2]OH完全反应;B为五元环酯。
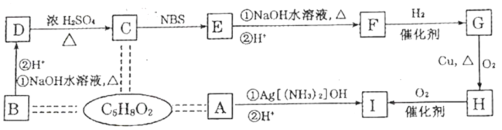
提示:CH3—CH=CH—R![]() Br—CH2—CH=CH—R
Br—CH2—CH=CH—R
(1)A中所含官能团是_____________。A与新制氢氧化铜悬浊液反应的方程式_________________________________。
(2)B、H的结构简式分别为_____________。
(3)写出下列反应方程式(有机化合物用结构简式表示)。
D→C:_____________________________________________________________。
E→F(只写①条件下的反应):_________________________________________。
(4)F的加聚产物的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
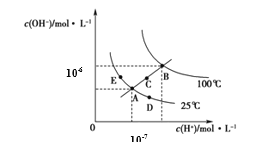
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
C.若从A点到D点,可采用在水中加入少量NaOH的方法
D.若处在B点温度时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知水的比热容为4.18×10-3 kJg-1℃-1.10g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500g H2O的温度由18℃升至62.4℃,则硫黄的燃烧热为__,热化学方程式为_.
(2)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下:
2P(s)+3Cl2(g)=2PCl3(g)△H=﹣612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g)△H=﹣798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为___.
(3)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
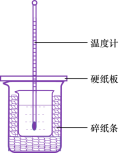
①从实验装置上看,图中尚缺少的一种玻璃用品是____.
②烧杯间填满碎纸条的作用是_.
③大烧杯上如不盖硬纸板,求得的中和热数值_(填“偏大、偏小、无影响”).
④如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热_(填“相等、不相等”).
⑤用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会__;(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,原理为:2XCl+2CO+ 2H2O==X2Cl2·2CO·2H2O
(1)X原子基态核外电子排布式为_________;
(2)C、H、O三种元素的电负性由大到小的顺序为________;
(3)H2O中氧原子的轨道杂化类型为__________;
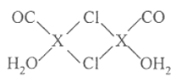
(4)X2Cl2·2CO·2H2O是一种配合物,结构如图所示,每个X原子能与其他原子形成3个配位键,在图中用“→"标出相应的配位键__。CO与N2分子的结构相似,则1molX2Cl2·2CO·2H2O含有δ键的数目为__。
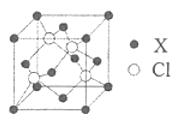
(5)化合物XCl晶体的晶胞如图所示,距离每个X离子最近的Cl的个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,在不同金属离子存在下,过氧化氢经过24h的分解率如下表所示:
离子 | 加入量(mg·L-1) | 分解率/% | 离子 | 加入量(mg·L-1) | 分解率/% |
无 |
| 2 | Fe2+ | 1.0 | 15 |
Al3+ | 10 | 2 | Cu2+ | 0.1 | 86 |
Zn2+ | 10 | 10 | Cr3+ | 0.1 | 96 |
下列有关说法正确的是
A.能使过氧化氢分解反应活化能降低最多的离子是Al3+
B.催化剂可以使平衡移动,提高过氧化氢的分解率
C.若向过氧化氢中加入水,过氧化氢的分解速率加快
D.用等量H2O2制O2时,与自身分解相比,加入足量酸性KMnO4溶液可得到更多O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推论正确的
A.![]() 的沸点高于
的沸点高于![]() ,可推测
,可推测![]() 的沸点高于
的沸点高于![]()
B.![]() 为正四面体结构,可推测出
为正四面体结构,可推测出![]() 也为正四面体结构
也为正四面体结构
C.![]() 晶体是分子晶体,可推测
晶体是分子晶体,可推测![]() 晶体也是分子晶体,
晶体也是分子晶体,
D.![]() 是碳链为直线型的非极性分子,可推测
是碳链为直线型的非极性分子,可推测![]() 也是碳链为直线型的非极性分子
也是碳链为直线型的非极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com