
【题目】水的电离平衡曲线如图所示,下列说法正确的是
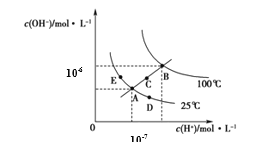
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
C.若从A点到D点,可采用在水中加入少量NaOH的方法
D.若处在B点温度时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
【答案】A
【解析】
A.水的离子积常数只一温度有关,与溶液的酸碱性无关,在同一温度下的Kw相同,升高温度,促进水的电离,水的离子积增大,所以图中五点KW间的关系:B>C>A=D=E,A正确;
B.若从A点到C点,由于Kw增大,所以只能采用升高温度的方法,B错误;
C.若从A点到D点,温度不变,c(H+)增大,则可采用在水中加入少量酸如HCl的方法,C错误;
D.B点时水的离子积Kw=10-12,若处在B点温度时,将pH=2的硫酸,c(H+)=10-2mol/L,pH=12的KOH溶液,c(OH-)=1mol/L,二者等体积混合,由于碱过量,所以混合后溶液显碱性,D错误;
故合理选项是A。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】下列各选项有机物同分异构体的数目,与分子式为C4H8O2的酯的有机物数目相同的是( )
A.分子式为C4H8的烯烃(包括顺反异构体)
B.分子式为C8H8O遇FeCl3溶液显紫色
C.分子式为ClC4H7O2,且能与碳酸氢钠反应生成气体
D.立方烷(![]() )的二氯代物
)的二氯代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJ/molS(l)+O2(g)=SO2(g) ΔH2=-296kJ/mol
一定条件下,可以通过CO与SO2反应生成S(1)和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的热化学方程式_______________________________。
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g);在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0 kpa,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g);在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0 kpa,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
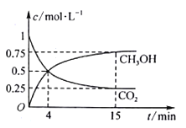
①0~4min,H2的平均反应速率v(H2)=________mol·L1·min1。
②CO2平衡时的体积分数为______________,该温度下Kp为_________kPa-2_(用含有p0的式子表示,小数点后保留1位)。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器甲 | 容器乙 |
反应物起始投入量 | 1mol CO2,3mol H2 | 0.5mol CO2,1mol H2 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol·L1 | C1 | C2 |
则乙容器中反应起始向________(填“正反应”或“逆反应”)方向进行;c1_________(填“>”“<”或“=”)c2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.金属铁原子核外电子运动状态有26种
B.金刚石晶胞中原子的体积占晶胞体积的百分率表达式为![]() π×100%
π×100%
C.从原子轨道重叠方式考虑,氮气分子中的共价键类型有σ键和π键
D.HCN分子的空间构型为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知: ![]()
![]()
![]()
则煤气化主要反应![]() ________________
________________
(2)已知![]() 的正反应速率为
的正反应速率为![]() ,逆反应速率为
,逆反应速率为![]() ,k为速率常数。2500K时,
,k为速率常数。2500K时, ![]() ,则该温度下的反应平衡常数K=_________________ 。
,则该温度下的反应平衡常数K=_________________ 。
(3)甲醇制甲醚的有关反应为: ![]() 一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
一定温度下,在三个容积均为1.0 L的恒容密闭容器中发生该反应。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH | CH3OCH3 | H2O | ||
I | 387 | 0. 20 | x | |
II | 387 | 0. 40 | y | |
Ⅲ | 207 | 0. 20 | 0. 090 | 0. 090 |
![]() ________________.
________________.
②已知![]() 时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol
时该反应的化学平衡常数K=4。该温度下,若起始时向容器I中充入0.10mol ![]() ,则反应将向_________(填“正”或“逆”)反应方向进行。
,则反应将向_________(填“正”或“逆”)反应方向进行。
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为______________(填序号)
A.升高温度 B.其他条件不变,增加![]() 的物质的量
的物质的量
C.降低温度 D.保持其他条件不变,通入氖气
(4)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中![]() 及
及![]() 的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:
的排放量意义重大。机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图所示:

①当空/燃比达到15后![]() 减少的原因可能是__________(填字母)。
减少的原因可能是__________(填字母)。
a.反应![]() 是吸热反应
是吸热反应
b.当空/燃比大干15后,燃油气燃烧放出的热量相应减少
②随空/燃比增大,CO和![]() 的含量减少的原因是______。
的含量减少的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硝酸与金属发生反应时,随着硝酸浓度的下降和金属活动性的增大,产物中氮元素的化合价会逐渐下降,它们可能是![]() 、NO、
、NO、![]() 、
、![]() 或
或![]() 中的一种或几种。某同学取一定量的铝铁合金与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入
中的一种或几种。某同学取一定量的铝铁合金与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入![]() 溶液,所加NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。试回答下列问题:
溶液,所加NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。试回答下列问题:
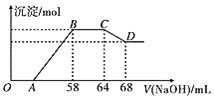
![]() 写出合金中铁与该稀硝酸反应的离子方程式:___________。
写出合金中铁与该稀硝酸反应的离子方程式:___________。
![]() 合金中铝的物质的量为__________mol,铁的物质的量为__________mol。
合金中铝的物质的量为__________mol,铁的物质的量为__________mol。
![]() 点对应的沉淀的物质的量为__________mol。
点对应的沉淀的物质的量为__________mol。
![]() 点对应的氢氧化钠溶液的体积为__________mL。
点对应的氢氧化钠溶液的体积为__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1LFeBr2溶液中,通入1.12L(标态下)的Cl2,测得溶液中c(Br-)=3c(Cl-),反应过程中溶液的体积变化不计,则下列说法中正确的是
A. 原溶液的浓度为0.1mol/L B. 反应后溶液中c(Fe3+)=0.1mol/L
C. 反应后溶液中c(Fe3+)=c(Fe2+) D. 原溶液中c(Br-)=0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请解答下列与蛋白质有关的题目:
(1)鸡蛋腐烂时,常闻到有臭鸡蛋气味的气体,该气体中主要含有___________________(填化学式),说明蛋白质中含有___________________(填元素名称)元素。
(2)误食重金属盐会中毒,这是因为___________________。
(3)浓硝酸溅在皮肤上,使皮肤呈现___________________色,这是由于浓硝酸和蛋白质发生了___________________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前我国的新冠肺炎防疫工作已取得了阶段性胜利,疫情中心武汉市已于4月8日零时解封。在国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》中,抗病毒治疗试用药物增加了磷酸氯喹。磷酸氯喹可由氯喹和磷酸在一定条件下制得。氯喹(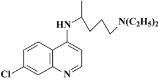 )可由以下路线合成:
)可由以下路线合成:
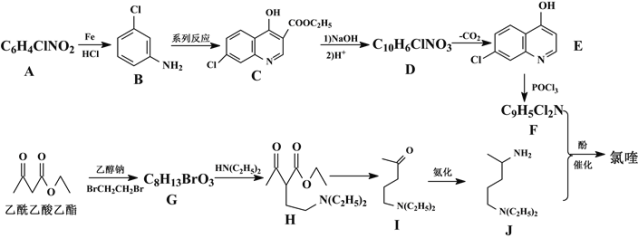
回答下列问题:
(1)A的名称为___,G中含氧官能团的名称为___,G→H的反应类型为___。
(2)写出F+J→氯喹的化学反应方程式___。
(3)有机物B与足量H2加成后的产物为X,试用“*”标出X中的手性碳原子___。
(4)M与H互为同分异构体,符合下列条件的M有___种。其中核磁共振氢谱中显示有7个吸收峰,峰面积比为6:4:4:4:3:1:1,其结构简式为___ (任写一种)。
①含有六元环和-N(C2H5)2②酸性条件下水解产物含乙酸③能发生酯化反应
(5)参照以上合成路线,请设计以1,3-丁二烯和苯为原料合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com