
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,原理为:2XCl+2CO+ 2H2O==X2Cl2·2CO·2H2O
(1)X原子基态核外电子排布式为_________;
(2)C、H、O三种元素的电负性由大到小的顺序为________;
(3)H2O中氧原子的轨道杂化类型为__________;
(4)X2Cl2·2CO·2H2O是一种配合物,结构如图所示,每个X原子能与其他原子形成3个配位键,在图中用“→"标出相应的配位键__。CO与N2分子的结构相似,则1molX2Cl2·2CO·2H2O含有δ键的数目为__。
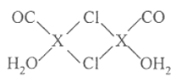
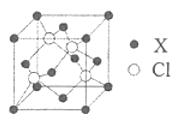
(5)化合物XCl晶体的晶胞如图所示,距离每个X离子最近的Cl的个数为________。
【答案】1s22s2p63s23p63d104s1或[Ar]3d104s1 O>C>H sp3 ![]() 14mol或14×6.02×1023 4
14mol或14×6.02×1023 4
【解析】
(1)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1,X为Cu,其原子基态核外电子排布式为1s22s2p63s23p63d104s1或[Ar]3d104s1;
(2)非金属性越强电负性越大,所以C、H、O三种元素的电负性由大到小的顺序为O>C>H;
(3)根据水的中心原子的氧原子的价电子数为(6+2)÷2=4,所以氧原子的杂化方式为sp3杂化;
(4)根据氯原子最外层电子数为7可知,氯原子可形成一对共用电子对,即氯原子形成两条共价键中只有一条是配位键,而X可形成3条配位键,故答案为![]() ,因1molX2Cl2·2CO·2H2O含有8mol配位键,4molH-O键,2molCO含2molδ键,H-O键和配位键都属于δ键,即1molX2Cl2·2CO·2H2O含有8+4+2=14molδ键,即14NA个δ键;
,因1molX2Cl2·2CO·2H2O含有8mol配位键,4molH-O键,2molCO含2molδ键,H-O键和配位键都属于δ键,即1molX2Cl2·2CO·2H2O含有8+4+2=14molδ键,即14NA个δ键;
(5)由晶包图可知晶包类型为ZnS,其晶包中配位数为4,距离每个X离子最近的Cl的个数为4。


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖B. 可采取分液的方法分离乙醇和水
C. 可用碘水检验淀粉是否完全水解D. 葡萄糖可以在酒曲酶作用下分解生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如图所示:
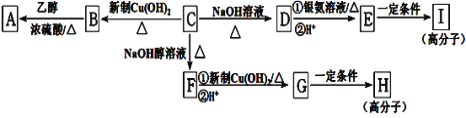
(1)C的结构简式是_____。
(2)E中含氧官能团的名称是______;C→F的反应类型是_____。
(3)写出下列化学方程式:G在一定条件下合成H的反应______。
(4)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有_____种,写出其中核磁共振氢谱有4个吸收峰的结构简式_____。
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列物质:a.碳棒;b.盐酸;c.H2SO4; d.氨水;e.熔融KOH;f.NH3;g.CCl4;h.CO2;i.冰醋酸;j.NaHSO4固体
①上述物质中,可导电的是:___;
②上述物质中,属于非电解质的是:____;
③上述物质中,属于电解质但不导电的是:_____;
④上述物质中,属于弱电解质的是:____.
⑤写出 i、j两种物质在水溶液中的电离方程式:i:____;j:____。
(2)25℃时,pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为____(体积变化忽略不计).
(3)有三瓶pH均为2的盐酸、硫酸溶液、醋酸溶液,设三种溶液的物质的量浓度依次为c1、c2、c3,则它们之间由小到大的顺序为_____(用c1、c2、c3排序).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.Fe2O3(s) ![]() Fe(s)
Fe(s)![]() FeCl2 (s)
FeCl2 (s)
B.Cu2S(s) ![]() Cu(s)
Cu(s) ![]() CuSO4 (aq)
CuSO4 (aq)
C.Al(s)![]() NaAlO2 (aq)
NaAlO2 (aq) ![]() Al(OH)3(s)
Al(OH)3(s)
D.NaCl(aq) ![]() NaHCO3 (s)
NaHCO3 (s) ![]() Na2CO3 (s)
Na2CO3 (s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离和提纯的方法错误的是
A.除去MgCl2溶液中的少量FeCl3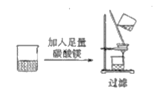
B.分离碘粉和铁粉的混合物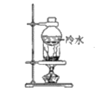
C.除去NaCl中的少量KNO3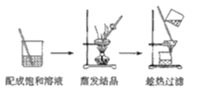
D.分离砂子、鸡蛋清和葡萄糖溶液的混合物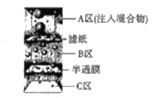
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为___________,![]() 能级上的未成对电子数为________。
能级上的未成对电子数为________。
(2)硫酸镍溶于氨水形成![]() 蓝色溶液。
蓝色溶液。
①![]() 中阴离子的立体构型是_______。
中阴离子的立体构型是_______。
②在![]() 中
中![]() 与
与![]() 之间形成的化学键称为__________,提供孤电子对的成键原子是__________。
之间形成的化学键称为__________,提供孤电子对的成键原子是__________。
③氨的沸点__________(填“高于”或“低于”)膦(![]() ),原因是_____________;氨是__________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为__________。
),原因是_____________;氨是__________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com