
【题目】下列推论正确的
A.![]() 的沸点高于
的沸点高于![]() ,可推测
,可推测![]() 的沸点高于
的沸点高于![]()
B.![]() 为正四面体结构,可推测出
为正四面体结构,可推测出![]() 也为正四面体结构
也为正四面体结构
C.![]() 晶体是分子晶体,可推测
晶体是分子晶体,可推测![]() 晶体也是分子晶体,
晶体也是分子晶体,
D.![]() 是碳链为直线型的非极性分子,可推测
是碳链为直线型的非极性分子,可推测![]() 也是碳链为直线型的非极性分子
也是碳链为直线型的非极性分子
科目:高中化学 来源: 题型:
【题目】金属氮化物具有高熔点、高硬度、高化学稳定性以及良好的导热、导电性,目前已经广泛应用于磁学、电子工业 、耐高温结构陶瓷等领域 。回答下列问题
(1)下列不同状态的氮原子其能量最高的是________(填字母),基态氮原子处于最高能级的电子其电子云轮廓图形状为________
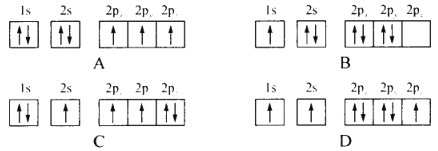
(2)第一电离能I1(N)______(填“> ”“< ”或“=”)I1(P),其原因是_____________。
(3)A和B两种金属的含氮化合物的结构如图所示:
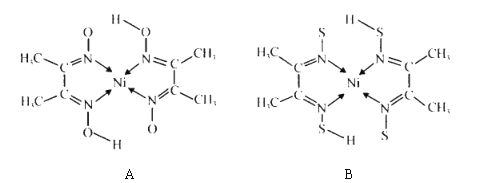
①基态 Ni 原子的核外电子排布式为[ Ar]________________。
②物质A 中碳原子的杂化方式为__________________。
③A的熔点高于 B 的,具主要原因是_______。
④B中含有的化学键类型有_____________(填字母)。
a.金属键 b. σ建
c.π键 d. 配位键
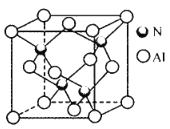
(4)氮化铝晶胞如图所示。氮原子的配位数为_______,每个铝原子周围紧邻__________个铝原子;已知立方氮化铝晶体密度为ρg cm-3,晶胞中最近的两个铝原子之间的距离为___pm(列出计算式即可,阿伏加德罗常数为6. 02×1023mol -1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.Fe2O3(s) ![]() Fe(s)
Fe(s)![]() FeCl2 (s)
FeCl2 (s)
B.Cu2S(s) ![]() Cu(s)
Cu(s) ![]() CuSO4 (aq)
CuSO4 (aq)
C.Al(s)![]() NaAlO2 (aq)
NaAlO2 (aq) ![]() Al(OH)3(s)
Al(OH)3(s)
D.NaCl(aq) ![]() NaHCO3 (s)
NaHCO3 (s) ![]() Na2CO3 (s)
Na2CO3 (s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离和提纯的方法错误的是
A.除去MgCl2溶液中的少量FeCl3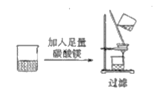
B.分离碘粉和铁粉的混合物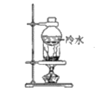
C.除去NaCl中的少量KNO3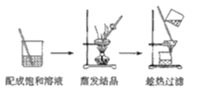
D.分离砂子、鸡蛋清和葡萄糖溶液的混合物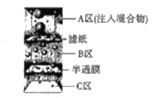
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新冠肺炎疫情期间,多种含氯消毒剂如84消毒液、Cl2、NaClO2等对病毒均具有很好的消杀作用,其中亚氯酸钠(NaClO2)在工业上常以ClO2气体为原料制备,实验室制备亚氯酸钠的装置如图所示(夹持装置已略)。
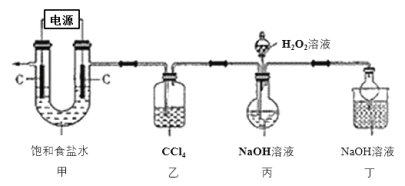
已知:①控制电压电解饱和食盐水可得到ClO2;
②Cl2易溶于CCl4;
③亚氯酸钠在不同温度下的溶解度如下表所示:
温度℃ | 20 | 40 | 60 |
溶解度/g | 6.2 | 23.4 | 48.3 |
回答下列问题:
(1)装置甲中产生ClO2的电极反应式为_____________________。
(2)装置乙中CCl4的作用为________________________________。
(3)装置丙中生成NaClO2的化学方程式为____________________________。
(4)从装置丙反应后的溶液中获得NaClO2晶体的步骤如下:
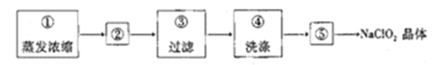
其中步骤①加热到_________________(填现象)时停止加热,步骤②是__________________。
(5)准确称取2.26gNaClO2粗品,加入盛有20.00mL刚煮沸并冷却过的水、足量10%的稀硫酸和30.00mL质量分数为40%的KI溶液(足量)的碘量瓶中,立即密封并摇晃碘量瓶至试样完全反应,再加入淀粉作指示剂用浓度为3.00mol/L的Na2S2O3溶液滴定(已知整个过程中发生的反应依次为![]() +4I-+4H+=2I2+Cl-+2H2O,
+4I-+4H+=2I2+Cl-+2H2O,![]() ),
),
①若三次平行实验测得消耗的Na2S2O3溶液的平均体积为30.00mL,则粗品的纯度为_________________%(保留三位有效数字),
②若使用的水未煮沸,则测定结果会___________________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为___________,![]() 能级上的未成对电子数为________。
能级上的未成对电子数为________。
(2)硫酸镍溶于氨水形成![]() 蓝色溶液。
蓝色溶液。
①![]() 中阴离子的立体构型是_______。
中阴离子的立体构型是_______。
②在![]() 中
中![]() 与
与![]() 之间形成的化学键称为__________,提供孤电子对的成键原子是__________。
之间形成的化学键称为__________,提供孤电子对的成键原子是__________。
③氨的沸点__________(填“高于”或“低于”)膦(![]() ),原因是_____________;氨是__________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为__________。
),原因是_____________;氨是__________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A.按系统命名法,化合物![]() 的名称为2-甲基-4-乙基戊烷
的名称为2-甲基-4-乙基戊烷
B.苯酚、水杨酸(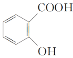 )和苯甲酸都是同系物
)和苯甲酸都是同系物
C.等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少
D.三硝基甲苯的分子式为C7H3N3O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2的结构可以表示为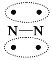 ,CO的结构可以表示为
,CO的结构可以表示为 ,其中椭圆框表示 π键,下列说法不正确的是( )
,其中椭圆框表示 π键,下列说法不正确的是( )
A.N2 分子与 CO 分子中都含有三键
B.CO 分子中有一个 π 键是配位键
C.N2 与 CO 互为等电子体
D.N2 与 CO 的化学性质相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com