
����Ŀ���¹ڷ��������ڼ䣬���ֺ�����������84����Һ��Cl2��NaClO2�ȶԲ��������кܺõ���ɱ���ã�������������(NaClO2)�ڹ�ҵ�ϳ���ClO2����Ϊԭ���Ʊ���ʵ�����Ʊ��������Ƶ�װ����ͼ��ʾ(�г�װ������)��
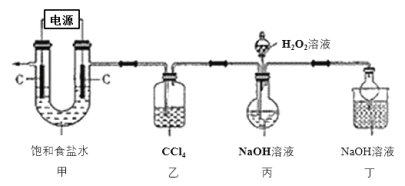
��֪���ٿ��Ƶ�ѹ��ⱥ��ʳ��ˮ�ɵõ�ClO2��
��Cl2������CCl4��
�����������ڲ�ͬ�¶��µ��ܽ�����±���ʾ��
�¶ȡ� | 20 | 40 | 60 |
�ܽ��/g | 6.2 | 23.4 | 48.3 |
�ش��������⣺
(1)װ�ü��в���ClO2�ĵ缫��ӦʽΪ_____________________��
(2)װ������CCl4������Ϊ________________________________��
(3)װ�ñ�������NaClO2�Ļ�ѧ����ʽΪ____________________________��
(4)��װ�ñ���Ӧ�����Һ�л��NaClO2����IJ������£�
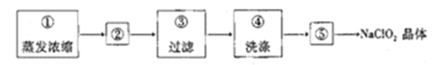
���в���ټ��ȵ�_________________(������)ʱֹͣ���ȣ��������__________________��
(5)ȷ��ȡ2.26gNaClO2��Ʒ������ʢ��20.00mL����в���ȴ����ˮ������10%��ϡ�����30.00mL��������Ϊ40%��KI��Һ(����)�ĵ���ƿ�У������ܷⲢҡ�ε���ƿ��������ȫ��Ӧ���ټ��������ָʾ����Ũ��Ϊ3.00mol/L��Na2S2O3��Һ�ζ�(��֪���������з����ķ�Ӧ����Ϊ![]() ��4I����4H��=2I2��Cl����2H2O��
��4I����4H��=2I2��Cl����2H2O��![]() )��
)��
��������ƽ��ʵ�������ĵ�Na2S2O3��Һ��ƽ�����Ϊ30.00mL�����Ʒ�Ĵ���Ϊ_________________%(������λ��Ч����)��
����ʹ�õ�ˮδ��У���ⶨ�����___________________(�ƫ�ߡ���ƫ�͡�����Ӱ�족)��
���𰸡�Cl- -5e- + 2H2O = ClO2��+ 4H+ ��ȥClO2�п��ܺ��е�Cl2 2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2 ��Һ������־�Ĥ ��ȴ�ᾧ 90.1 ƫ��
��������
�����⼰װ��ͼ��֪��װ�ü�ͨ�����Ƶ�ѹ��ⱥ��ʳ��ˮ��ȡClO2��ClO2�п��ܺ���Cl2��Cl2��NaOH��Ӧ�����ɴ������ƻ������ƣ���װ���ҵ������dz�ȥCl2����װ�ñ��У��������ԭClO2��ȡNaClO2��װ�ö��������ն����ClO2����ֹ��Ⱦ����������NaClO2���ܽ�����ݿ�֪�����ܽ�����¶ȵı仯���仯���ԣ���˿�ͨ����NaClO2��Һ��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ�NaClO2���壬�ݴ˷������
(1)װ�ü�ͨ�����Ƶ�ѹ��ⱥ��ʳ��ˮ��ȡClO2����Ԫ�ػ��ϼ����ߣ�����ʧ���ӵ�������Ӧ����װ�ü��в���ClO2�ĵ缫��ӦʽΪCl- - 5e- + 2H2O = ClO2��+ 4H+��
(2)�����Ϸ���֪��װ������CCl4������Ϊ��ȥClO2�п��ܺ��е�Cl2��
(3)װ�ñ��У��������ԭClO2��ȡNaClO2�����ݵ�ʧ�����غ㡢Ԫ���غ���ƽ�÷�Ӧ�Ļ�ѧ����ʽΪ2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2��
(4)����NaClO2���ܽ�����ݿ�֪�����ܽ�����¶ȵı仯���仯���ԣ���˿�ͨ����NaClO2��Һ��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ�NaClO2���壬��˲���ټ��ȵ���Һ������־�Ĥʱֹͣ���ȣ����������ȴ�ᾧ��
(5)������֪��Ӧ�ɵù�ϵʽ��NaClO2~2I2~4S2O32-����m(NaClO2)=![]() �����Ʒ�Ĵ���Ϊ
�����Ʒ�Ĵ���Ϊ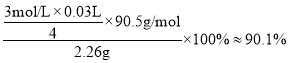 ��
��
����ʹ�õ�ˮδ��У�ˮ�лẬ��������������Ҳ���������������ɵⵥ�ʣ��Ӷ�ʹ���ĵ�Na2S2O3��Һ�����������ⶨ�����ƫ�ߡ�


 �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ⷨ�Ʊ���������(KH2PO4)װ����ͼ��ʾ������˵����ȷ����
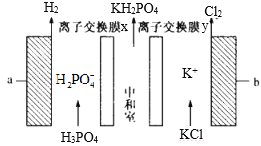
A.�� a �����ӵĵ�Դ���Ʊ� b �ĸ�
B.���ӽ���Ĥ x��y �ֱ�Ϊ���� �ӡ������ӽ���Ĥ
C.���ʱ����������ͬʱ����ͨ������Ĥ�����������������
D.�����·��ͨ�� 1mol ����ʱ������ll.2L��Cl2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��֪ˮ�ı�����Ϊ4.18��10-3 kJg-1��-1��10g�����O2����ȫȼ��������̬SO2���ų���������ʹ500g H2O���¶���18������62.4�棬����Ƶ�ȼ����Ϊ__���Ȼ�ѧ����ʽΪ_��
(2)����P(s)��Cl2(g)������Ӧ����PCl3(g)��PCl5(g)����Ӧ�������£�
2P(s)+3Cl2(g)��2PCl3(g)��H����612kJ/mol
2P(s)+5Cl2(g)��2PCl5(g)��H����798kJ/mol
��̬PCl5������̬PCl3��Cl2���Ȼ�ѧ����ʽΪ___��
(3)��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺
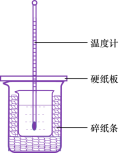
�ٴ�ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��____��
���ձ���������ֽ����������_��
�۴��ձ����粻��Ӳֽ�壬��õ��к�����ֵ_(����ƫ��ƫС����Ӱ����)��
�������60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������_________(������ȡ��������)�������к���_(������ȡ��������)��
������ͬŨ�Ⱥ�����İ�ˮ(NH3H2O)����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ��__��(����ƫ��������ƫС��������Ӱ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100��ʱ���ڲ�ͬ�������Ӵ����£��������⾭��24h�ķֽ������±���ʾ��
���� | ��������mg��L��1�� | �ֽ���/% | ���� | ��������mg��L��1�� | �ֽ���/% |
�� |
| 2 | Fe2�� | 1.0 | 15 |
Al3�� | 10 | 2 | Cu2�� | 0.1 | 86 |
Zn2�� | 10 | 10 | Cr3�� | 0.1 | 96 |
�����й�˵����ȷ����
A.��ʹ��������ֽⷴӦ��ܽ�������������Al3��
B.��������ʹƽ���ƶ�����߹�������ķֽ���
C.������������м���ˮ����������ķֽ����ʼӿ�
D.�õ���H2O2��O2ʱ���������ֽ���ȣ�������������KMnO4��Һ�ɵõ�����O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��N��ԭ������������������ֶ���������Ԫ�����������γ�һ���л���(�ṹ��ͼ)������Ԫ��ԭ�ӵ�����������֮��Ϊ24��Z��Nͬ���壬M�Ƿǽ�������ǿ��Ԫ�أ�����˵���������
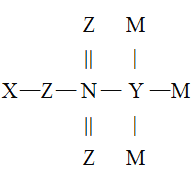
A.��������ϼۣ�N��Y��X
B.Z��N�ɷֱ���X�γɵȵ������Ļ�����
C.ԭ�Ӱ뾶��N��Z��Y��M��X
D.Y��N������ij�ֺ�������ʹ����KMnO4��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ��
A.![]() �ķе����
�ķе����![]() �����Ʋ�
�����Ʋ�![]() �ķе����
�ķе����![]()
B.![]() Ϊ��������ṹ�����Ʋ��
Ϊ��������ṹ�����Ʋ��![]() ҲΪ��������ṹ
ҲΪ��������ṹ
C.![]() �����Ƿ��Ӿ��壬���Ʋ�
�����Ƿ��Ӿ��壬���Ʋ�![]() ����Ҳ�Ƿ��Ӿ��壬
����Ҳ�Ƿ��Ӿ��壬
D.![]() ��̼��Ϊֱ���͵ķǼ��Է��ӣ����Ʋ�
��̼��Ϊֱ���͵ķǼ��Է��ӣ����Ʋ�![]() Ҳ��̼��Ϊֱ���͵ķǼ��Է���
Ҳ��̼��Ϊֱ���͵ķǼ��Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����Ƶ�����ˮ�ⷴӦ��ͼ��ʾ���г�װ��ʡ�ԣ�������˵��������ǣ� ��
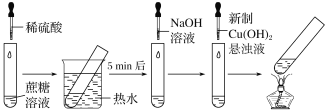
A.ϡ�������ˮԡ���ܼӿ�����ˮ������
B.�μ�NaOH��Һ��Ŀ���ǵ���Һ��pH������
C.���������ں��Թ������ɺ�ɫ����
D.ʵ������֤������ˮ���л�ԭ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����������Ͷ��FeCl3��Һ�У�����ǡ����ȫ��Ӧ������������⡣
��1��д���÷�Ӧ�����ӷ���ʽ���������ת�Ƶķ������Ŀ__________________��
��2���÷�Ӧ����������ͻ�ԭ��������ʵ���֮��Ϊ____________��
��3������Ӧ������ת����0.2mol���ӣ����ܽ����ĵ���������Ϊ___________��
��4����μ���ijδ֪��Һ���Ƿ���Fe3+________________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com