
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F均用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F均用所对应的元素符号表示):| 5-1×3 |
| 2 |
| 6-2×2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 4 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、研究有机物的一般步骤是:分离、提纯→确定化学式→确定实验式→确定结构式 |
| B、在碱性条件下,将0.1mol的CH3CO18OC2H5水解,所得乙醇的相对分子质量为48 |
| C、制硝基苯、银镜反应、溴乙烷的水解、酯的水解实验条件都是水浴加热 |
| D、裂化汽油、聚1,3-丁二烯、福尔马林溶液都能使溴水褪色,但原理不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 正极 | Cu | Ag | 石墨 | Mg |
| 负极 | Zn | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | CuSO4 | CuCl2 | Cu(NO3)2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
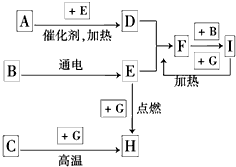
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:X>Y>Z |
| B、气态氢化物的稳定性Y>X>Z |
| C、单质熔点:Y>X>Z |
| D、简单阴离子的还原性:Y>Z>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com