
| A、研究有机物的一般步骤是:分离、提纯→确定化学式→确定实验式→确定结构式 |
| B、在碱性条件下,将0.1mol的CH3CO18OC2H5水解,所得乙醇的相对分子质量为48 |
| C、制硝基苯、银镜反应、溴乙烷的水解、酯的水解实验条件都是水浴加热 |
| D、裂化汽油、聚1,3-丁二烯、福尔马林溶液都能使溴水褪色,但原理不完全相同 |


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:

| A、可以和溴水反应 |
| B、可溶于有机溶剂 |
| C、分子中有三个苯环 |
| D、1mol维生素P最多可以和4molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
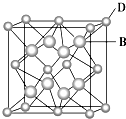 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/nm | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 | 0.102 | 0.143 |
| 最高或最低化合价 | -2 | +2 | +1 | +5 -3 | +7 -1 | +1 | +5 -3 | +3 | +6 -2 | +3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
如图所示是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )| A、大理石和稀硫酸制取二氧化碳 |
| B、锌粒和稀硫酸制氢气 |
| C、浓盐酸和二氧化锰制取氯气 |
| D、固体NH4Cl和消石灰制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X中肯定有碳碳双键 |
| B、X中可能有三个羟基和一个 一COOR官能团 |
| C、X中可能有两个羧基和一个羟基 |
| D、X中可能有三个羧基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1 1 |
2 1 |
3 1 |
23 12 |
24 12 |
16 8 |
17 8 |
18 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F均用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F均用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度和体积相同的K2CO3、K2SO4、HCl溶液混合后,溶液的pH<7 | ||
| B、NH4HSO4稀溶液中,c(SO42-)>c(NH4+)>c(H+)>c(OH -) | ||
C、将0.1mol/L的CH3COOH溶液加水稀释,溶液中的
| ||
| D、t℃时,某稀Ba(OH)2溶液中c(H+)?c(OH -)=1.0×10-12.向pH=8的该溶液中加入等体积pH=4的盐酸,则混合后溶液pH=6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com