
| 元素 代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/nm | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 | 0.102 | 0.143 |
| 最高或最低化合价 | -2 | +2 | +1 | +5 -3 | +7 -1 | +1 | +5 -3 | +3 | +6 -2 | +3 |


科目:高中化学 来源: 题型:
A、 |
B、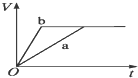 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、研究有机物的一般步骤是:分离、提纯→确定化学式→确定实验式→确定结构式 |
| B、在碱性条件下,将0.1mol的CH3CO18OC2H5水解,所得乙醇的相对分子质量为48 |
| C、制硝基苯、银镜反应、溴乙烷的水解、酯的水解实验条件都是水浴加热 |
| D、裂化汽油、聚1,3-丁二烯、福尔马林溶液都能使溴水褪色,但原理不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
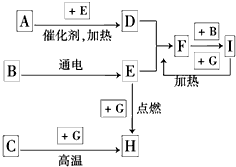
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com