
| A.分别还原a mol Fe2O3所需H2、Al、CO物质的量之比为3 ∶2 ∶3 |
| B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 |
| C.工业上可用铁制容器储存、运输浓硝酸、浓硫酸 |
| D.检验某物质是否含Fe2O3的操作步骤为:样品→粉碎→加热→溶解→过滤→向滤液中加KSCN溶液 |
科目:高中化学 来源:不详 题型:单选题
| A.该晶体中没有SCN- | B.Fe3+的氧化性比Cl2的氧化性强 |
| C.Fe2+被Cl2氧化为Fe3+ | D.Fe2+与SCN-形成血红色的化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5 |
| B.向溶液中通入Cl2,再加入CuO粉末调节至pH4-5 |
| C.向溶液中通入Cl2,在通入NH3调节至pH4-5 |
| D.向溶液中通入H2O2, 再加入CuO粉末调节至pH4-5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.消耗硫酸亚铁铵的物质量为n(2-x)mol |
| B.处理废水中Cr2O72-的物质量为mol |
| C.反应中发生转移的电子数为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
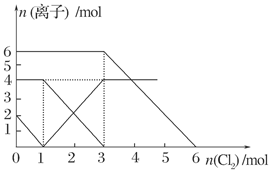
| A.还原性:I->Fe2+>Br- |
| B.原混合溶液中FeBr2的物质的量为6 mol |
| C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| D.原溶液中:n(Fe2+) ∶n(I-) ∶n(Br-)=2 ∶1 ∶3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu、Fe3+ | B.Fe2+、Fe3+ | C.Cu、Cu2+ | D.Cu、Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
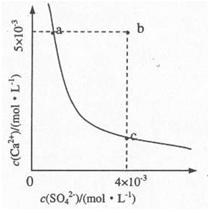
| A.加入适量CaCl2 | B.加入适量BaCl2. |
| C.加人适量Na2SO4 | D.蒸发 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

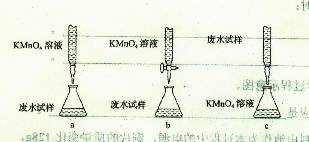
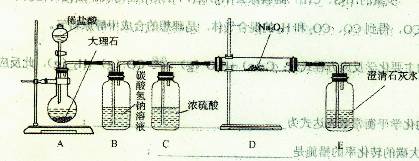
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com