
ЎҫМвДҝЎҝТТЛбХэ¶ЎхҘКЗОЮЙ«НёГчУРУдҝм№ыПгЖшО¶өДТәМеЈ¬ҝЙУЙТТЛбәНХэ¶ЎҙјЦЖұёЎЈ·ҙУҰөД»ҜС§·ҪіМКҪИзПВЈә![]()
·ўЙъөДёұ·ҙУҰИзПВЈә
УР№Ш»ҜәПОпөДОпАнРФЦКјыПВұнЈә
»ҜәПОп | ГЬ¶ИЈЁgЎӨcm-3Ј© | Л®ИЬРФ | ·РөгЈЁЎжЈ© |
ұщТТЛб | 1.05 | ТЧИЬ | 118.1 |
Хэ¶Ўҙј | 0.80 | ОўИЬ | 117.2 |
Хэ¶ЎГС | 0.77 | І»ИЬ | 142.0 |
ТТЛбХэ¶ЎхҘ | 0.90 | ОўИЬ | 126.5 |
ТСЦӘЈәТТЛбХэ¶ЎхҘЎўХэ¶ЎҙјәНЛ®ЧйіЙИэФӘ№І·РОпәг·РөгОӘ90.7ЎжЎЈ
әПіЙЈә
·Ҫ°ёјЧЈәІЙУГЧ°ЦГјЧЈЁ·ЦЛ®ЖчФӨПИјУИлЛ®Ј¬К№Л®ГжВФөНУЪ·ЦЛ®ЖчөДЦ§№ЬҝЪЈ©Ј¬ФЪёЙФпөД50mLФІөЧЙХЖҝЦРЈ¬јУИл11.5mLЈЁ0.125molЈ©Хэ¶ЎҙјәН7.2mLЈЁ0.125molЈ©ұщҙЧЛбЈ¬ФЩјУИл3Ў«4өОЕЁБтЛбәН2g·РКҜЈ¬ТЎФИЎЈ°ҙПВНј°ІЧ°әГҙш·ЦЛ®ЖчөД»ШБч·ҙУҰЧ°ЦГЈ¬НЁАдИҙЛ®Ј¬ФІөЧЙХЖҝФЪөзИИМЧЙПјУИИЦу·РЎЈФЪ·ҙУҰ№эіМЦРЈ¬НЁ№э·ЦЛ®ЖчПВІҝөДРэИы·ЦіцЙъіЙөДЛ®ЈЁЧўТвұЈіЦ·ЦЛ®ЖчЦРЛ®ІгТәГжИФұЈіЦФӯАҙёЯ¶ИЈ¬К№УНІгҫЎБҝ»ШөҪФІөЧЙХЖҝЦРЈ©ЎЈ·ҙУҰ»щұҫНкіЙәуЈ¬НЈЦ№јУИИЎЈ
·Ҫ°ёТТЈәІЙУГЧ°ЦГТТЈ¬јУБП·ҪКҪУл·Ҫ°ёјЧПаН¬ЎЈјУИИ»ШБчЈ¬·ҙУҰ60minәуНЈЦ№јУИИЎЈ

МбҙҝЈәјЧТТБҪ·Ҫ°ёҫщІЙУГХфБу·Ҫ·ЁЎЈІЩЧчИзПВЈә

Зл»ШҙрЈә
ЈЁ1Ј©aҙҰЛ®Бч·ҪПтКЗ ЈЁМоЎ°ҪшЛ®Ўұ»тЎ°іцЛ®ЎұЈ©Ј¬ТЗЖчbөДГыіЖ ЎЈ
ЈЁ2Ј©әПіЙІҪЦиЦРЈ¬·Ҫ°ёјЧјаҝШхҘ»Ҝ·ҙУҰТС»щұҫНкіЙөДұкЦҫКЗ ЎЈ
ЈЁ3Ј©Мбҙҝ№эіМЦРЈ¬ІҪЦиўЪКЗОӘБЛіэИҘУР»ъІгЦРІРБфөДЛбЈ¬јмСйУР»ъІгТСіКЦРРФөДІЩЧчКЗ Ј»ІҪЦиўЫөДДҝөДКЗ ЎЈ
ЈЁ4Ј©ПВБРУР№ШПҙөУ№эіМЦР·ЦТәВ©¶·өДК№УГХэИ·өДКЗ ЎЈ
AЈ®·ЦТәВ©¶·К№УГЗ°ұШРлТӘјмВ©Ј¬Ц»ТӘ·ЦТәВ©¶·өДРэИыРҫҙҰІ»В©Л®јҙҝЙК№УГ
BЈ®ПҙөУКұХсТЎ·ЕЖшІЩЧчУҰИзНјЛщКҫ
CЈ®·ЕіцПВІгТәМеКұЈ¬РиҪ«ІЈБ§ИыҙтҝӘ»тК№ИыЙПөД°јІЫ¶ФЧјВ©¶·ҝЪЙПөДРЎҝЧ
DЈ®ПҙөУНкіЙәуЈ¬ПИ·ЕіцПВІгТәМеЈ¬И»әујМРшҙУПВҝЪ·ЕіцУР»ъІгЦГУЪёЙФпөДЧ¶РОЖҝЦР

ЈЁ5Ј©°ҙЧ°ЦГұыХфБуЈ¬ЧоәуФІөЧЙХЖҝЦРІРБфөДТәМеЦчТӘКЗ Ј»Иф°ҙНј¶Ў·ЕЦГОВ¶ИјЖЈ¬ФтКХјҜөҪөДІъЖ·Бу·ЦЦР»№ә¬УР ЎЈ
ЈЁ6Ј©КөСйҪб№ыұнГч·Ҫ°ёјЧөДІъВКҪПёЯЈ¬ФӯТтКЗ ЎЈ
Ўҫҙр°ёЎҝЈЁ1Ј©ҪшЛ® ЈЁ1·ЦЈ© ЈЁЦұРОЈ©АдДэ№Ь
ЈЁ2Ј©·ЦЛ®ЖчЦРЛ®І»ФЩЙъіЙ»т·ЦЛ®ЖчЦРөДЛ®ІгІ»ФЩФцјУКұЈЁ1·ЦЈ©
ЈЁ3Ј©УГІЈБ§°фХәИЎУР»ъІгЈ¬өгФЪpHКФЦҪЙПЈ¬УлұкЧјұИЙ«ҝЁ¶ФХХЈ¬¶БИЎpHЦөЕР¶ПЈЁ2·ЦЈ©
іэИҘИЬУЪхҘЦРөДЙЩБҝОЮ»ъСОЈЁ1·ЦЈ©
ЈЁ4Ј©BCЈЁ2·ЦЈ¬В©СЎёш1·ЦЈ¬ҙнСЎІ»ёш·ЦЈ©ЈЁ5Ј©Хэ¶ЎГС ЈЁ1·ЦЈ© Хэ¶ЎҙјЈЁ1·ЦЈ©
ЈЁ6Ј©НЁ№э·ЦЛ®Жчј°Кұ·ЦАліцІъОпЛ®ЈЁ1·ЦЈ©Ј¬УРАыУЪхҘ»Ҝ·ҙУҰөДҪшРРЈ¬МбёЯхҘөДІъВКЈЁ1·ЦЈ©
ЎҫҪвОцЎҝ
КФМв·ЦОцЈәЈЁ1Ј©АдИҙЧ°ЦГЦРЈ¬АдИҙЛ®РиТӘДжБчЈ¬ТтҙЛaҙҰҪшЛ®Ј»ТЗЖчbОӘАдДэ№ЬЎЈ
ЈЁ2Ј©өұ·ЦЛ®ЖчЦРЛ®І»ФЩЙъіЙ»тХЯ·ЦЛ®ЖчЦРөДЛ®ІгІ»ФЩФцјУКұЈ¬ұнГжхҘ»Ҝ·ҙУҰТС»щұҫНкіЙЈ»
ЈЁ3Ј©Мбҙҝ№эіМЦРЈ¬ІҪЦиўЪКЗОӘБЛіэИҘУР»ъІгЦРІРБфөДЛбЈ¬ҝЙУГpHКФЦҪјмСйУР»ъІгТСіКЦРРФЈ¬ҫЯМеІЩЧчКЗЈәУГІЈБ§°фХәИЎУР»ъІгЈ¬өгФЪpHКФЦҪЙПЈ¬УлұкЧјұИЙ«ҝЁ¶ФХХЈ¬¶БИЎpHЦөЕР¶ПЈ»ІҪЦиўЫУГ10mLЛ®ПҙЈ¬ДҝөДКЗіэИҘИЬУЪхҘЦРөДЙЩБҝОЮ»ъСОЎЈ
ЈЁ4Ј©A.РэИыәНІЈБ§ИыҙҰҫщТӘјмСйКЗ·сВ©Л®Ј¬AҙнОуЈ»B.ПҙөУКұХсТЎ·ЕЖшІЩЧчХэИ·Ј¬BХэИ·Ј»C.·ЕіцПВІгТәМеКұЈ¬РиҪ«ІЈБ§ИыҙтҝӘ»тК№ИыЙПөД°јІЫ¶ФЧјВ©¶·ҝЪЙПөДРЎҝЧЈ¬ІЩЧчХэИ·Ј¬CХэИ·Ј»D.ПҙөУНкіЙәуЈ¬ҙУПВҝЪ·ЕіцПВІгТәМеЈ¬ҙУЙПҝЪө№іцУР»ъІгЦГУЪёЙФпөДЧ¶РОЖҝЈ¬DҙнОуЎЈ№Кҙр°ёBCЎЈ
ЈЁ5Ј©°ҙЧ°ЦГұыХфБуЈ¬ФІөЧЙХЖҝЦРІРБфөДТәМеКЗ·РөгёЯөДХэ¶ЎГСЈ»ОВ¶ИјЖУҰ·ЕФЪЦ§№ЬҝЪЈ¬Иф°ҙНј¶Ё·ЕЦГОВ¶ИјЖЈ¬ФтКХјҜөҪөДІъЖ·Бу·ЦЦР»№УР·РөгҪПөНөДХэ¶ЎҙјЎЈ
ЈЁ6Ј©УЙУЪ·Ҫ°ёјЧЦРЈ¬НЁ№э·ЦЛ®Жчј°КұҪ«ІъОпЛ®·ЦАліцАҙЈ¬УРАыУЪхҘ»Ҝ·ҙУҰөДХэПтҪшРРЈ¬УРАыУЪМбёЯхҘөДІъВКЈ¬ТтҙЛ·Ҫ°ёјЧөДІъВКҪПёЯЎЈ


 КұҝМЧјұёЧЕКојЩЧчТөФӯЧУДЬіц°жЙзПөБРҙр°ё
КұҝМЧјұёЧЕКојЩЧчТөФӯЧУДЬіц°жЙзПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіСРҫҝРФС§П°РЎЧйМҪҫҝFeSO4өД»ҜС§РФЦКәНУГНҫЎЈ»ШҙрПВБРОКМвЈә
ЈЁ1Ј©МҪҫҝFeSO4ИЬТәөДЛбјоРФЈәИЎЙЩБҝFeSO4№ММеЈ¬АыУГКҜИпКФТәІвКФFeSO4ИЬТәөДЛбјоРФЈ¬ұШРлСЎУГөДТЗЖчУРҪәН·өО№ЬЎўТ©іЧәН ЎЈ
AЈ®ІЈБ§°ф BЈ®КФ№Ь CЈ®МмЖҪ DЈ®БҝНІ
ЈЁ2Ј©АыУГПВНјЧ°ЦГМҪҫҝFeSO4өДОИ¶ЁРФ
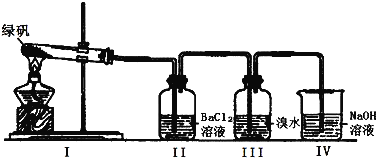
ўЩIIЦРУР°ЧЙ«іБөнЙъіЙЈ¬РЎЧйіЙФұҪбәПАнВЫ·ЦОцЈ¬ИПОӘПВБР·ЦҪвІъОпІ»ҝЙДЬөДКЗ ЎЈ
AЈ®Fe2O3 ЎўSO3 ЎўH2O
BЈ®Fe2O3 ЎўSO2 ЎўSO3 ЎўH2O
CЈ®FeO ЎўFe2O3 ЎўSO2 ЎўSO3 ЎўH2O
ўЪIIIЦРдеЛ®КЗУГАҙјмСйКЗ·сУРSO2ЖшМеЙъіЙЈ¬ИфУРSO2ЙъіЙЈ¬деЛ®Ҫ«НКЙ«ЎЈКөСйЦРЈ¬№ЫІмөҪдеЛ®НКЙ«Ј¬ҫЭҙЛНЖІвFeSO4·ЦҪвЧоУРҝЙДЬұ»Сх»ҜөДФӘЛШКЗ ЎЈ
ўЫNaOHөДЧчУГКЗОьКХSO2ЖшМеЈ¬ЗлРҙіцЧоҙуБҝОьКХSO2ЖшМеөД·ҙУҰ»ҜС§·ҪіМКҪЈә ЎЈ
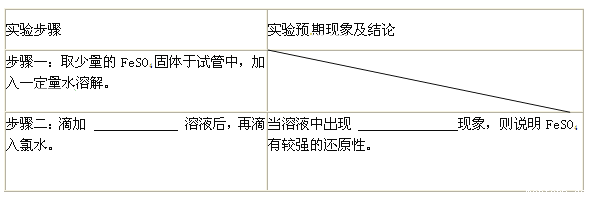
ЈЁ3Ј©МҪҫҝFeSO4ЦРFe2+»№ФӯРФЈә
ЦӨГчFeSO4УРҪПЗҝөД»№ФӯРФЈ¬НкіЙПВұнЎЈ
ЈЁ4Ј©БтЛбСЗМъУГНҫМҪҫҝ
ИұМъРФЖ¶СӘНщНщҝЪ·юБтЛбСЗМъЈ¬өұУГБтЛбСЗМъЦЖіЙТ©Ж¬КұЈ¬Нвұн°ьУРТ»ІгМШКвөДМЗТВЈ¬ЖдЧчУГКЗ ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№ШУЪФӯөзіШәНөзҪвіШөДРрКцХэИ·өДКЗЈЁ Ј©
AЈ®ФӯөзіШЦРК§ИҘөзЧУөДөзј«ОӘХэј«
BЈ®ФӯөзіШөДёәј«ЎўөзҪвіШөДСфј«¶ј·ўЙъСх»Ҝ·ҙУҰ
CЈ®ФӯөзіШөДБҪј«Т»¶ЁКЗУЙ»о¶ҜРФІ»Н¬өДБҪЦЦҪрКфЧйіЙ
DЈ®өзҪвКұөзҪвіШөДТхј«Т»¶ЁКЗТхАлЧУ·Еөз
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
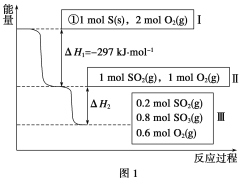
ЎҫМвДҝЎҝәгОВәгИЭМхјюПВЈ¬БтҝЙТФ·ўЙъИзПВЧӘ»ҜЈ¬Жд·ҙУҰ№эіМәНДЬБҝ№ШПөИзНј1ЛщКҫ
[ТСЦӘЈә2SO2(g)Ј«O2(g)![]() 2SO3(g) ҰӨHЈҪЈӯ196.6 kJЎӨmolЈӯ1]Јә
2SO3(g) ҰӨHЈҪЈӯ196.6 kJЎӨmolЈӯ1]Јә
Зл»ШҙрПВБРОКМвЈә
(1)РҙіцДЬұнКҫБтөДИјЙХИИөДИИ»ҜС§·ҪіМКҪЈә____________________ЎЈ
(2)ҰӨH2ЈҪ_____________________ЎЈ
(3)әгОВәгИЭКұЈ¬1 mol SO2әН2 mol O2ід·Ц·ҙУҰЈ¬·ЕіцИИБҝөДКэЦөұИ|ҰӨH2|________(МоЎ°ҙуЎұЎўЎ°РЎЎұ»тЎ°ПаөИЎұ)ЎЈ
(4)Ҫ«ўуЦРөД»мәПЖшМеНЁИлЧгБҝөДNaOHИЬТәЦРПыәДNaOHөДОпЦКөДБҝОӘ__________Ј¬ИфИЬТәЦР·ўЙъБЛСх»Ҝ»№Фӯ·ҙУҰЈ¬ФтёГ№эіМөДАлЧУ·ҪіМКҪОӘ______________________ЎЈ
(5)ПтН¬ОВЎўН¬Ме»эөДИэёцГЬұХИЭЖчЦР·ЦұрідИлЖшМеЈә(јЧ)2 mol SO2 әН1 mol O2Ј»(ТТ) 1 mol SO2 әН0.5 mol O2Ј»(ұы) 2 mol SO3Ј»әгОВЎўәгИЭПВ·ҙУҰҙпЖҪәвКұЈ¬ПВБР№ШПөТ»¶ЁХэИ·өДКЗ( )
AЈ®ИЭЖчДЪС№ЗҝpЈәpјЧЈҪpұыЈҫ2pТТ
BЈ®SO3өДЦКБҝmЈәmјЧЈҪmұыЈҫ2mТТ
CЈ®c(SO2)Улc(O2)Ц®ұИkЈәkјЧЈҪkұыЈҫkТТ
DЈ®·ҙУҰ·Еіц»тОьКХИИБҝөДКэЦөQЈәQјЧЈҪQұыЈҫ2QТТ
(6)ДіSO2(g)әНO2(g)МеПөЈ¬Кұјдt1ҙпөҪЖҪәвәуЈ¬ёДұдДіТ»НвҪзМхјюЈ¬·ҙУҰЛЩВКvУлКұјдtөД№ШПөИзНј2ЛщКҫЈ¬ИфІ»ёДұдSO2(g)әНO2(g)өДБҝЈ¬ФтНјЦРt4КұТэЖрЖҪәвТЖ¶ҜөДМхјюҝЙДЬКЗ__________Ј»НјЦРұнКҫЖҪәв»мәПОпЦРSO3өДә¬БҝЧоёЯөДТ»¶ОКұјдКЗ____________ЎЈ
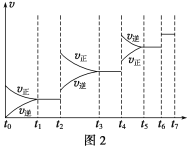
(7)ёчҪЧ¶ОЖҪәвКұ¶ФУҰөДЖҪәвіЈКэИзПВұнЛщКҫЈә
t1Ў«t2 | t3Ў«t4 | t5Ў«t6 | t6Ў«t7 |
K1 | K2 | K3 | K4 |
K1ЎўK2ЎўK3ЎўK4Ц®јдөД№ШПөОӘ__________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіСРҫҝРФС§П°РЎЧйҪ«ПВБРЧ°ЦГИзНјБ¬ҪУЈ¬CЎўDЎўEЎўFЎўXЎўY¶јКЗ¶иРФөзј«ЎЈҪ«өзФҙҪУНЁәуЈ¬ПтТТЦРөОИл·УМӘКФТәЈ¬ФЪFј«ёҪҪьПФәмЙ«ЎЈКФ»ШҙрПВБРОКМвЈә

(1)өзФҙBј«өДГыіЖКЗ________ЎЈ
(2)Из№ыКХјҜТТЧ°ЦГЦРБҪј«ІъЙъөДЖшМеЈ¬БҪј«ЖшМеөДОпЦКөДБҝЦ®ұИКЗ________ЎЈ
(3)јЧЧ°ЦГЦРөзҪв·ҙУҰөДЧЬ»ҜС§·ҪіМКҪЈә_______________________ЎЈ
(4)УыУГұыЧ°ЦГёшМъ¶ЖРҝЈ¬GУҰёГКЗ_______(МоЎ°МъЎұ»тЎ°РҝЎұ)Ј¬өз¶ЖТәөДЦчТӘіЙ·ЦКЗ_______(Мо»ҜС§КҪ)ЎЈ
(5)Ч°ЦГ¶ЎЦРөДПЦПуКЗ___________________
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝёЗЛ№¶ЁВЙЦёіцЈә»ҜС§·ҙУҰөД·ҙУҰИИЦ»Ул·ҙУҰөДКјМ¬әНЦХМ¬УР№ШЈ¬¶шУлҫЯМе·ҙУҰҪшРРөДНҫҫ¶ОЮ №ШЎЈОпЦКAФЪТ»¶ЁМхјюПВҝЙ·ўЙъТ»ПөБРЧӘ»ҜЈ¬УЙНјЕР¶ППВБР№ШПөҙнОуөДКЗ( )
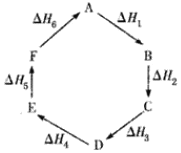
AЈ®AЎъFЈәҰӨHЈҪЈӯҰӨH6
BЈ®ҰӨH1Ј«ҰӨH2Ј«ҰӨH3Ј«ҰӨH4Ј«ҰӨH5Ј«ҰӨH6ЈҪ1
CЈ®CЎъFЈә|ҰӨH|ЈҪ|ҰӨH1Ј«ҰӨH2Ј«ҰӨH6|
DЈ®|ҰӨH1Ј«ҰӨH2Ј«ҰӨH3|ЈҪ|ҰӨH4Ј«ҰӨH5Ј«ҰӨH6|
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУР»ъОпAЦ»ә¬УРCЎўHЎўOИэЦЦФӘЛШЈ¬іЈУГЧчУР»ъәПіЙөДЦРјдМеЎЈ16.8 gёГУР»ъОпИјЙХЙъіЙ44.0 g CO2әН14.4 g H2OЈ»ЦКЖЧНјұнГчЖдПа¶Ф·ЦЧУЦКБҝОӘ84Ј¬әмНв№вЖЧ·ЦОцұнГчA·ЦЧУЦРә¬УРOЎӘHјьәНО»УЪ·ЦЧУ¶ЛөДCЎФCјьЈ¬әЛҙЕ№ІХсЗвЖЧЙПУРИэёц·еЈ¬·еГж»эЦ®ұИОӘ6ЎГ1ЎГ1ЎЈ
ЈЁ1Ј©AөД·ЦЧУКҪКЗ Ј¬AөДҪб№№јтКҪКЗ
ЈЁ2Ј©УР»ъОпBКЗAөДН¬·ЦТм№№МеЈ¬1 mol BҝЙУл1 mol Br2јУіЙЎЈёГУР»ъОпЦРЛщУРМјФӯЧУФЪН¬Т»ёцЖҪГжЙПЈ¬Г»УРЛі·ҙТм№№ПЦПуЎЈBөДҪб№№јтКҪКЗ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУГПВНјЛщКҫЧ°ЦГјмСйТТП©КұІ»РиТӘіэФУөДКЗЈЁ Ј©

ТТП©өДЦЖұё | КФјБX | КФјБY | |
A | CH3CH2BrУлNaOHТТҙјИЬТә№ІИИ | H2O | KMnO4ЛбРФИЬТә |
B | CH3CH2BrУлNaOHТТҙјИЬТә№ІИИ | H2O | Br2өДCCl4ИЬТә |
C | C2H5OHУлЕЁH2SO4јУИИЦБ170 Ўж | NaOHИЬТә | KMnO4ЛбРФИЬТә |
D | C2H5OHУлЕЁH2SO4јУИИЦБ170 Ўж | NaOHИЬТә | Br2өДCCl4ИЬТә |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝСх»ҜГҫФЪТҪТ©ЎўҪЁЦюөИРРТөУҰУГ№г·әЎЈБтЛбГҫ»№ФӯИИҪвЦЖұёёЯҙҝСх»ҜГҫКЗТ»ЦЦРВөДМҪЛчЎЈТФБвГҫҝу(ЦчТӘіЙ·ЦОӘMgCO3Ј¬ә¬ЙЩБҝFeCO3 )ОӘФӯБПЦЖұёёЯҙҝСх»ҜГҫөДКөСйБчіМИзПВЈә

ЙъіЙЗвСх»ҜОпіБөнөДpHЈә
Mg(OH)2 | Fe(OH)2 | Fe(OH)3 | |
ҝӘКјіБөнКұ | 9.4 | 6.3 | 1.5 |
НкИ«іБөнКұ | 12.4 | 8.3 | 2.8 |
ЈЁ1Ј©MgCO3 УлПЎБтЛб·ҙУҰөДАлЧУ·ҪіМКҪОӘ_______________________ЎЈ
ЈЁ2Ј©јУЛ«СхЛ®өДДҝөД______________________Ј»Па№ШөДАлЧУ·ҪіМКҪ_________________________Ј»јУ°ұЛ®өчҪЪИЬТәөДPH·¶О§ОӘ______________ЎЈ
ЈЁ3Ј©ВЛФь2 өДіЙ·ЦКЗ_____________(Мо»ҜС§КҪ)ЎЈ
ЈЁ4Ј©мСЙХ№эіМҙжФЪТФПВ·ҙУҰЈә2MgSO4+C![]() 2MgO+2SO2Ўь+CO2Ўь
2MgO+2SO2Ўь+CO2Ўь
MgSO4+C![]() MgO+SO2Ўь+COЎь
MgO+SO2Ўь+COЎь
MgSO4+3C![]() MgO+SЎь+3COЎь
MgO+SЎь+3COЎь
АыУГПВНјЧ°ЦГ¶ФмСЙХІъЙъөДЖшМеҪшРР·ЦІҪОьКХ»тКХјҜЎЈ
ўЩDЦРКХјҜөДЖшМеҝЙТФКЗ________________(Мо»ҜС§КҪ)ЎЈ
ўЪBЦРКў·ЕөДИЬТәҝЙТФКЗ________________(МоЧЦДё)ЎЈ
aЈ®NaOH ИЬТә bЈ®Na2CO3 ИЬТә cЈ®ПЎПхЛб dЈ®KMnO4ИЬТә
ўЫAЦРөГөҪөДөӯ»ЖЙ«№ММеУлИИөДNaOHИЬТә·ҙУҰЈ¬ІъОпЦРФӘЛШЧоёЯјЫМ¬ОӘ+4Ј¬РҙіцёГ·ҙУҰөДАлЧУ·ҪіМКҪЈә__________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com