



科目:高中化学 来源:不详 题型:单选题
 Ca2+(aq)+2OH-(aq),下列方法中,能使c(Ca2+)减小、c(OH-)增大的是
Ca2+(aq)+2OH-(aq),下列方法中,能使c(Ca2+)减小、c(OH-)增大的是| A.加入少量MgCl2固体 | B.加入少量Na2CO3固体 |
| C.加入少量KCl固体 | D.加入少量CaO固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.直接加碱,调整溶液pH≥9.6 |
| B.加纯铜粉,将Fe2+还原出来 |
| C.通入适量Cl2,再加碱调整溶液的pH为4 |
| D.直接加铁粉将Cu2+还原出来 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
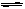 Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是 ( )
Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是 ( )| A.溶液中Pb2+和I-浓度都增大。 | B.溶度积常数Ksp增大 |
| C.沉淀溶解平衡向左移动 | D.浓度商Qc增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.对于平衡Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),加入NH4Cl溶液,可使Ca(OH)2减小 |
| B.在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Ksp(AgBr)降低 |
| C.温度一定时,当溶液中c(Ag+)和c(Cl-)的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| D.把固体AgCl加入较浓的KI溶液中振荡,部分AgCl转化为AgI,其原因是AgI比AgCl稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 BaCO
BaCO 3(s)+SO42-(aq)(平衡常数K=0.042)
3(s)+SO42-(aq)(平衡常数K=0.042)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤,损耗AgCl少 |
| B.等体积的 pH均等于3的盐酸和AlCl3溶液中,已电离的水分子数前者一定小于后者 |
| C.高效催化剂可使水分解,同时释放能量 |
| D.明矾用于净水和氯气用于自来水的杀菌消毒,两个反应遵循的化学原理不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
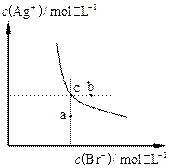
| A.向溴化银的浊液中加入溴化钠溶液, 溴化银的Ksp减小 |
| B.图中a点对应的是不饱和溶液 |
C.向c点的溶液中加入0.1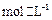 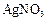 ,则 ,则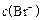 减小 减小 |
| D.升高温度可以实现c点到b点的转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com