
【题目】如图是铜-锌原电池示意图。下列有关该原电池的描述中正确的是( )

A.锌片作正极,不断溶解
B.铜片作负极,有气泡产生
C.负极反应:Zn2++2e-=Zn
D.正极反应:2H++2e-=H2↑
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】双氧水在医疗、军事和工业上用途广泛,工业上合成双氧水的方法有多种,其中一种合成工艺为乙基蒽醌(EAQ)法。
已知:
①反应原理为
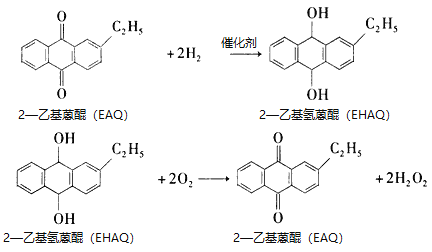
②工业制备流程如图所示。
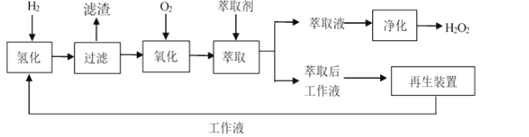
③制备过程中,将EAQ溶于有机溶剂中配制成工作液。
请回答下列问题:
(1)该流程中,循环使用的原料为___。
(2)现有甲、乙、丙三种有机溶剂,相关物质的溶解情况如表所示,则配制工作液时,应选用有机溶剂__(填“甲”“乙”或“丙”),原因为___。
物质 | 甲 | 乙 | 丙 |
EAQ | 互溶 | 不溶 | 互溶 |
EHAQ | 互溶 | 不溶 | 互溶 |
H2O2 | 不溶 | 不溶 | 互溶 |
H2O | 不溶 | 不溶 | 互溶 |
(3)“氧化”时,控制温度为45~55℃,原因为___。
(4)“萃取”时,所选用的萃取剂是一种常见的溶剂,其化学名称为__,选用该溶剂作为萃取剂的原因为__。
(5)“净化”的目的是将萃取液中的过氧化氢分离出来,则应选用的分离方法为___。
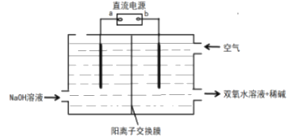
(6)采用电解法制备双氧水的装置示意图如图所示,通入空气的电极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-丙二醇脱氧脱水反应的催化循环机理如下图所示。

下列说法不正确的是
A. 产物CH2=CHCH3不存在顺反异构
B. 过程②中有O—H键发生断裂
C. 过程③④中均有C—C键发生断裂
D. 该反应方程式为:2CH2(OH)CH(OH)CH3![]() HCHO+CH3CHO+CH2=CHCH3+2H2O
HCHO+CH3CHO+CH2=CHCH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应2SO2(g)+O2(g)![]() 2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3 mol·L-1。则0~10s内平均反应速率为
2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3 mol·L-1。则0~10s内平均反应速率为
A. ![]()
B. ![]()
C. ![]()
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置做浓硫酸和蔗糖反应的实验。下列有关实验操作或叙述错误的是( )

A.打开A中分液漏斗活塞,加入浓硫酸,充分反应后烧瓶内出现黑色膨化固体
B.品红溶液红色褪去,证明有SO2气体生成
C.检验A中产生的气体中含有水蒸气,应将E接在A和B之间
D.D中溶液变浑浊,即可证明反应产生了CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类利用能源经历了三个时期。
(1)柴草时期:从能量转化的角度看,木材燃烧时化学能主要转化成__能和光能。
(2)化石能源时期:天然气的主要成分是甲烷。甲烷的电子式为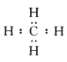 ,其化学键类型是__(选填“离子键”或“共价键”)
,其化学键类型是__(选填“离子键”或“共价键”)
(3)石油化工生产可以合成某有机物,其分子球棍模型如图所示。
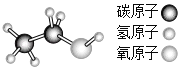
据此写出该物质的结构式或结构简式__。
(4)多能源结构时期:基于环保理念,将逐步减少传统燃油汽车的使用,燃料电池汽车将有更广阔的发展前景。下图为氢氧燃料电池的示意图,其基本工作原理与铜锌原电池相同。

根据图中电子流动方向判断A电极是__(选填“正极”或“负极”);氢氧燃料电池的优点是__(写一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100mol·L-1 NaOH溶液分别滴定10.00 mL 浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示:
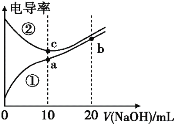
下列说法正确的是
A.曲线②代表滴定盐酸的曲线
B.滴定醋酸的过程应该选择甲基橙作为指示剂
C.a、b、c三点溶液中水的电离程度:a>c>b
D.b点溶液中:c(OH-)=c(H+)+c(CH3COO-)+ c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
(1)已知:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH1
CO(g)+H2O(g)CO2(g)+H2(g) ΔH2
2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH3
用ΔH2、ΔH3表示ΔH1,ΔH1=_________。
(2)针对CO2与H2反应转化为二甲醚(g)和H2O(g),研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:
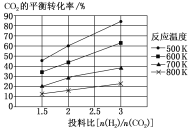
①ΔH1________(填“>”或“<”)0。
②若其他条件不变,仅仅增大压强,则逆反应速率会________(填“增大”“减小”或“不变”,下同),平衡常数K会________。
(3)研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为2CO(g)+SO2(g)2CO2(g)+S(l) ΔH=-270 kJ·mol-1。
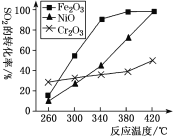
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是________________
②若在2 L恒容密闭容器中,将3mol CO、1 mol SO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=________。
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是_____(填字母)。
A.CO B.SO2 C.N2 D.H2S E.CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
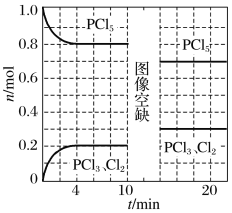
下列说法正确的是
A.0~4 min的平均速率v(PCl3)=0.025 mol·L-1·min-1
B.10 min时改变的条件是增加了一定量的PCl5
C.若起始时向该容器中充入2.0 mol PCl3和2.0 mol Cl2,保持温度为T,反应达平衡时放出的热量小于1.6a kJ
D.温度为T,起始时向该容器中充入1.0 mol PCl5、0.10 mol PCl3和0.10 mol Cl2,反应达到平衡前v正<v逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com