
【题目】现有一瓶A和B的混合液,已知它们的性质如表.
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
A | ﹣11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B分离的常用方法是( )
A.蒸馏
B.分液
C.过滤
D.蒸发
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定量的硫酸铜溶液,实验装置如下图甲。电解过程中的实验数据如下图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体 积(标准状况)。则下列说法不正确的是
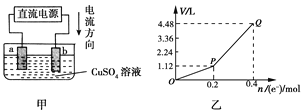
A. 电解过程中,a电极表面先有红色物质析出,后有气泡产生
B. b电极上发生反应的方程式为:4OH--4e-=2H2O+O2↑
C. 曲线O~P段表示O2的体积变化
D. 从开始到Q点时收集到的混合气体的平均摩尔质量为12 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品.反应方程式为
2AgNO3+4KOH+K2S2O8![]() Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式: .
(3)准确称取上述制备的样品(设仅含Ag2O2和Ag2O) 2.558g,在一定的条件下完全分解为Ag 和O2,得到224.0mLO2(标准状况下).计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种元素的原子,其价电子排布分别为4s2、3s2 3p2 和2s2 2p4,由这三种元素组成的化合物的化学式可能是
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体(K2Cr2O7)和铁红的流程如下:
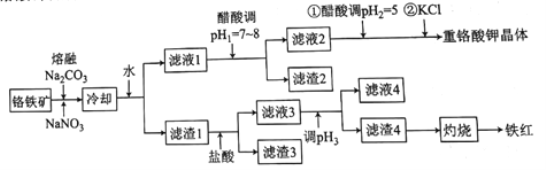
已知:I.常见离子开始生成沉淀和沉淀完全的pH如下表所示:
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀的pH | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全的pH | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
II.熔融Na2CO3条件下主要发生反应:
2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
(1)熔融Na2CO3条件下还可以得到的副产物为NaAlO2和Na2SiO3,生成这两种副产物的化学方程式为___________________。
(2)滤渣2的主要成分为________(填化学式)。
(3)用醋酸调节pH2=5的目的为__________;若调节的pH过低,NO2-可被氧化为NO3-,其离子方程式为______________。
(4)调节pH2后,加入KCl控制一定条件,可析出K2Cr2O7晶体的可能理由是_______。
(5)调节pH3的范围为______。
(6)检验滤液4中Fe3+是否沉淀完全的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)①常温下,.某溶液中由水电离出的c(OH﹣)=1.0×10﹣10mol/L,该溶液可以是 . (填选项)
A.pH=4的CH3COOH
B.pH=10的NaOH
C.pH=9的 Na2CO3
D.pH=2的 H2SO4
E.pH=4的 NH4Cl
(2)在100℃时,将 100mL 0.1mol/L 的稀H2SO4溶液与 100mL 0.4mol/L的NaOH 溶液混合后,溶液的pH= . (混合时溶液体积变化忽略不计,己知Kw=10﹣12).
(3)常温下,amL0.1mol/L盐酸与bmL0.1mol/L氨水混合,充分反应,若混合后溶液呈中性,则ab (填“<”、“>”或“=”).
(4)常温下,amLpH=3的盐酸与bmLpH=11的氨水混合,充分反应,若a=b,则反应后溶液中离子浓度从大到小的顺序是 .
(5)氯化铝水溶液呈酸性,原因是(用离子方程式表示>: . 把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
(6)25℃,在0.10mol/LH2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2﹣)关系如下图(忽略溶液体积的变化、H2S的挥发). ①pH=13时,溶液中的 c(H2S)+c(HS﹣)=mol/L.
②某溶液含 0.020mol/LMn2+、0.10mol/LH2S,当溶液pH=时,Mn2+开始沉淀.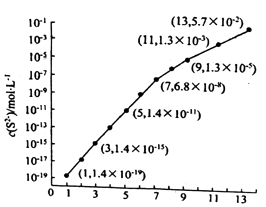
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的本质特征是
A.胶体分散质粒子直径介于1nm~100nm之间B.胶体能产生丁达尔现象
C.胶体是一种澄清透明的分散系D.胶体可用于净水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥主要成分是MgO(占40%),还含有Na2B4O7、CaO、Al2O3、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取MgSO4·7H2O的工艺流程如下:
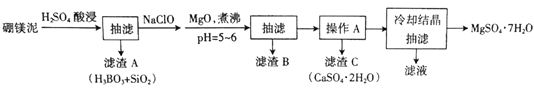
已知部分金属阳离子沉淀的pH:Fe(OH)3:3.2,Al(OH)3:5.2,Fe(OH)2:9.7,Mg(OH)2:11.2。
(1)为提高酸浸时浸出速率,可采取的措施有______________(写出两条)。
(2)H2SO4和Na2B4O7发生反应的化学方程式为________________。
(3)加入NaClO后可以生成一种不溶于水的黑色固体,则反应的离子方程式为_________。
(4)加MgO煮沸,并调整溶液pH=5~6的目的是_______________。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 10℃ | 20℃ | 40℃ | 60℃ |
MgSO4 | 28.2 | 33.7 | 44.5 | 54.6 |
CaSO4 | 0.244 | 0.255 | 0.264 | 0.265 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4。除去,根据上表数据,步骤为________________,__________________。
(6)本实验中多次用到抽滤操作,其装置如图,相比普通过滤,抽滤的优点是____________________。
(7)实验中提供的硼镁泥共100g,得到MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com