
【题目】工业上用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体(K2Cr2O7)和铁红的流程如下:
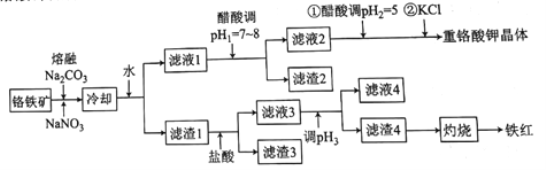
已知:I.常见离子开始生成沉淀和沉淀完全的pH如下表所示:
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀的pH | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全的pH | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
II.熔融Na2CO3条件下主要发生反应:
2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
(1)熔融Na2CO3条件下还可以得到的副产物为NaAlO2和Na2SiO3,生成这两种副产物的化学方程式为___________________。
(2)滤渣2的主要成分为________(填化学式)。
(3)用醋酸调节pH2=5的目的为__________;若调节的pH过低,NO2-可被氧化为NO3-,其离子方程式为______________。
(4)调节pH2后,加入KCl控制一定条件,可析出K2Cr2O7晶体的可能理由是_______。
(5)调节pH3的范围为______。
(6)检验滤液4中Fe3+是否沉淀完全的方法是____________。
【答案】 Na2CO3+Al2O3![]() 2NaAlO2+CO2↑、Na2CO3+SiO2
2NaAlO2+CO2↑、Na2CO3+SiO2![]() 2Na2SiO3+CO2↑ H2SiO3、Al(OH)3 将CrO42-转化为Cr2O72- Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O 在该条件下K2Cr2O7的溶解度最低,更易以晶体形式析出 3.2≤pH<8.1 取少量滤液于试管中,滴加KSCN溶液, 溶液未变红即可证明Fe3+沉淀完全,反之未沉淀完全
2Na2SiO3+CO2↑ H2SiO3、Al(OH)3 将CrO42-转化为Cr2O72- Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O 在该条件下K2Cr2O7的溶解度最低,更易以晶体形式析出 3.2≤pH<8.1 取少量滤液于试管中,滴加KSCN溶液, 溶液未变红即可证明Fe3+沉淀完全,反之未沉淀完全
【解析】(1)生成NaAlO2和Na2SiO3的化学方程式为Na2CO3+Al2O3![]() 2NaAlO2+CO2↑、Na2CO3+SiO2
2NaAlO2+CO2↑、Na2CO3+SiO2![]() 2Na2SiO3+CO2↑;
2Na2SiO3+CO2↑;
(2)调pH=7-8,是为了得到沉淀H2SiO3、Al(OH)3;
(3)用醋酸调节pH2=5的目的是为将CrO42-转化为Cr2O72-;若pH调节的过低会发生反应Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O。
(4)调节PH2后,加人KCI控制一定条件,可析出K2Cr2O7晶体的可能理由是在该条件下K2Cr2O7的溶解度最低。
(5)为了让Fe3+沉淀完全,而Mg2+不沉淀,调节pH3的范围为3.2≤pH<8.1。
(6)检验滤液4中Fe3+是否沉淀完全的方法是取少量滤液于试管中,滴加KSCN溶液,若溶液未变红即可证明Fe3+沉淀完全,反之未沉淀完全。


科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)Si(s)+4HCl(g)△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(Lmin)
D.反应吸收0.025Q kJ热量时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含有少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取。

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表所示。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)“熔融”时ZrSiO4发生反应的化学方程式为________________________________。
(2)“滤渣Ⅰ”的化学式为________________。
(3)为使滤液Ⅰ中的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是________;继续加氨水至pH=b时,所发生反应的离子方程式为__________________________________________。
(4)向“过滤Ⅲ”所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的使用,下列说法中错误的是
A.容量瓶不能用于溶解固体
B.容量瓶不能用于加热
C.容量瓶可以用来长期存放溶液
D.容量瓶可以用于配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl﹣)>c(OH﹣)>cCH3COO﹣)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3H2O)>c(NH4+)>c(Cl﹣)>c(OH﹣)
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: ![]() c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42﹣)+c(HC2O4﹣)+c(OH﹣)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶A和B的混合液,已知它们的性质如表.
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
A | ﹣11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B分离的常用方法是( )
A.蒸馏
B.分液
C.过滤
D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答问题:
(1)相同温度下等物浓度的下列溶液中. A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是(用对应的字母填写).
②NH4+离子浓度由大到小的顺序是(用对应的字母填写).
③若上述溶液的pH值相同,则其物成的量浓度关系是(用对应的字母填写).
(2)25℃.向50mL 0.018molL﹣1 的 AgNO3溶液中加入50mL 0.020molL﹣1的盐酸,生成沉淀.己知该温度下AgCl的Ksp=1.0×10﹣10 , 忽略溶液的体积变化,请计算: ①完全沉淀后,溶液中c(Ag+)= .
②完全沉淀后,溶液的pH= .
(3)弱酸及其盐在水中存在多种平衡关系.己知NaA水溶液呈碱性,常温下将0.1molNaA和0.05molHCl溶于水,得到1L溶液. ①己知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为 .
②向该混合物中再加0.03molNaOH,溶液中n(A﹣)+n(OH﹣)﹣n(H+)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g).若经2s后测得C的浓度为0.6molL﹣1 , 现有下列几种说法:其中正确的是( ) ①用物质A表示的反应的平均速率为0.3molL﹣1s﹣1
②用物质B表示的反应的平均速率为0.6molL﹣1s﹣1
③2s时物质B的浓度为0.7molL﹣1
④2s末,物质A的转化率为70%
A.①④
B.①③
C.②④
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的一部分,根据①~⑨在周期表中的位置,用元素符号或化学式回答下列问题:
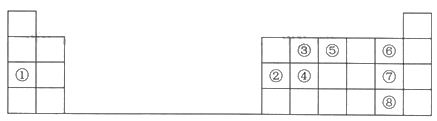
(1)元素④在元素周期表中的位置为________。
(2)最高价氧化物的水化物中碱性最强的物质的电子式为________。
(3)写出②和⑦两种元素的最高价氧化物的水化物相互反应的化学方程式:_______。
(4)④、⑤、⑥三种元素按原子半径由大到小的顺序排列为_______。
(5)③和⑦两种元素形成的简单化合物的结构式为_______,空间构型为________。
(6)设计实验探究⑦、⑧两种元素非金属性的相对强弱。
可选用的试剂有:氯水、NaBr溶液、AgNO3溶液、苯。
请完成实验报告单。
步骤一 | 步骤二 | |
实验内容 | 试管1:取少量氯水; 试管2:取少量氯水,滴加少量NaBr溶液。 | 分别向试管1、试管2中加少量______(填试剂),振荡,静置。 |
实验现象 | 试管2中的现象是______。 | 试管2中的现象是_______。 |
实验分析 | 试管1的作用是_____。 | 试管2中反应的离子方程式为_____,此实验的结论是_____。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com