
【题目】实验室通常用图所示的装置来制取氨气。请按要求回答下列问题:
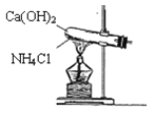
(1)实验室制取氨气的化学反应方程式为__。
(2)除了以上方法。下面也能用于制备氨气的是___。
①固态氯化铵加热分解
②浓氨水中加入固体氢氧化钠
③加热浓氨水
(3)NH3的催化氧化的化学反应方程式为__。
(4)①用装置A收集氨气时,应选择氨气的进气口是___(选填“a”或“b”),并说明选择的理由___。
②打开装置A中的止水夹,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是___、___。
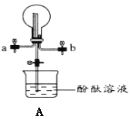
(5)通常可以用什么方法来检验无色溶液中是否有NH4+___。
【答案】Ca(OH)2+2NH4Cl![]() CaCl2 +2H2O+2NH3↑ ②③ 4NH3+5O2
CaCl2 +2H2O+2NH3↑ ②③ 4NH3+5O2 ![]() 4NO+6H2O a 氨气的密度比空气密度小 氨气极易溶于水 氨气与水反应生成碱 加入强碱并加热,生成的气体能使湿润的红色石蕊试纸变蓝
4NO+6H2O a 氨气的密度比空气密度小 氨气极易溶于水 氨气与水反应生成碱 加入强碱并加热,生成的气体能使湿润的红色石蕊试纸变蓝
【解析】
(1)在加热条件下,氯化铵和氢氧化钙反应生成氨气、氯化钙和水;
(2)①固态氯化铵加热分解生成氯化氢和氨气,在试管口遇冷后又生成氯化铵,则无法制取氨气;
②浓氨水中加入固体氢氧化钠,NaOH溶于水放出大量热,放出的热量促进一水合氨分解而生成氨气,能制取氨气;
③加热浓氨水,能使氨气从氨水中逸出,制取到氨气;
(3)在催化剂加热条件下,NH3与O2反应生成NO和水;
(4)①氨气的密度小于空气,冲入的氨气占据容器的上部;
②氨气易溶于水,使容器内压强迅速减小,形成喷泉实验;溶液显红色,则溶液显碱性;
(5)NH3能使湿润的红色石蕊试纸变蓝色。
(1)在加热条件下,氯化铵和氢氧化钙反应生成氨气、氯化钙和水,反应方程式为Ca(OH)2+2NH4Cl![]() CaCl2 +2H2O+2NH3↑;
CaCl2 +2H2O+2NH3↑;
(2)①固态氯化铵加热分解生成氯化氢和氨气,在试管口遇冷后又生成氯化铵,则无法制取氨气;
②浓氨水中加入固体氢氧化钠,NaOH溶于水放出大量热,温度升高导致氨气的溶解度降低,能制取氨气;
③加热浓氨水,能使氨气从氨水中逸出,制取到氨气;
答案为②③;
(3)在催化剂加热条件下,NH3与O2反应生成NO和水,4NH3+5O2 ![]() 4NO+6H2O;
4NO+6H2O;
(4)①氨气的密度小于空气,充入的氨气占据容器的上部,则应从a进b出;
②氨气易溶于水,使容器内压强迅速减小,形成喷泉实验;溶液显红色,则溶液显碱性;
(5)NH3能使湿润的红色石蕊试纸变蓝色,可以向溶液中加入强碱并加热的条件下生成使湿润的红色试纸变蓝色的气体检验NH4+的存在。


科目:高中化学 来源: 题型:
【题目】磷化硼(BP)是一种受到高度关注的金属保护层耐磨材料,可由三溴化硼和三溴化磷在氢气中高温制得。
(1)合成BP的反应中,基态原子未成对电子最多的元素符号为____,核外电子数最多的元素的基态原子电子占据最高能级上的电子数为____。B所在的周期第一电离能最大的元素名称为____。
(2)三溴化磷分子的中心原子价层电子对数为____,分子空间结构为____形。BBr3空间结构为____形,PBr3分子中键角比BBr3分子中键角____(填>、<或=)。
(3)N与P同主族。科学家在一定条件下把氮气(氮氮三键键能为942kJmol-1)聚合为固体高聚氮,全部以N-N键相连且键能为160kJmol-1,这种固体高聚氮可能潜在的用途是____,这是因为____。
(4)BP晶胞,磷原子在晶胞中采用金属铜原子的堆积方式,硼原子填充在其四面体空隙中,则其四面体填充率为____,已知晶胞参数a=478pm,则硼和磷原子的核间距为____pm(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往一体积不变的密闭容器中充入H2和I2,发生反应 H2(g)+I2(g)![]() 2HI(g);△H>0达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
2HI(g);△H>0达到平衡后,t0时改变反应的某一条件(混合气体物质的量不变),且造成容器内压强增大,下列说法正确的是
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度不变
C.由于压强增大,导至H2,I2(g),HI平衡浓度都增大
D.改变的条件是升温,速率图象为下图

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn是一种应用广泛的金属。用闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS、砷化合物杂质等)为原料制备金属Zn和ZnSO4·7H2O的流程如图所示:

①相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
回答下列问题:
(1)滤渣1的主要成分除SiO2外还有______,焙烧后产生的气体对环境造成的常见危害为______。
(2)氧化除杂工序中加入ZnO的作用是___________。
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用的试剂为____________。
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为___________。不能省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+,理由是________。
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的阳极反应式为_____________;沉积锌后的电解液可返回______工序继续使用。
(6)酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,写出该反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:则CH4的燃烧热为( )
![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g)+H2O(l) ΔH=-445.15 kJ·mol-1
CO2(g)+H2O(l) ΔH=-445.15 kJ·mol-1
CH4(g)+![]() O2(g)=CO(g)+2H2O(l) ΔH=-607.3 kJ·mol-1
O2(g)=CO(g)+2H2O(l) ΔH=-607.3 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
A.445.15 kJ·mol-1B.890.3 kJ·mol-1
C.607.3 kJ·mol-1D.802.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法正确的是( )
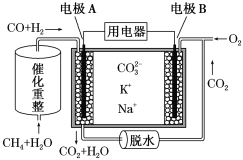
A.电池工作时,CO32-向电极B移动
B.电极B上发生的电极反应为O2+2CO2+4e-=2 CO32-
C.电极A上H2参与的电极反应为H2+2OH--2e-=2H2O
D.反应CH4+H2O 3H2+CO,每消耗1 mol CH4转移12 mol电子
3H2+CO,每消耗1 mol CH4转移12 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式的书写正确的是
A.氢氧化钡溶液与稀硫酸反应:SO![]() + Ba2+ = BaSO4 ↓
+ Ba2+ = BaSO4 ↓
B.将氯气通入氯化亚铁溶液中:Cl2+2Fe2+=2Fe3++2Cl![]()
C.用FeCl3溶液蚀刻印刷电路板上的Cu:2Fe3++3Cu=2Fe+3Cu2+
D.硫酸与碳酸氢钠溶液反应:2H++CO![]() =H2O+ CO2↑
=H2O+ CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料的不断发展可以促进社会进步。 完成下列填空:
(1) “玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中使用了镁铝合金,选用镁铝合金的优点是____________________。(任写一点)
(2)光导纤维简称“光纤”,是一种由玻璃制成、能传输光线、结构特殊的玻璃纤维。现在家中的电话线和网线大都采用光纤线。光纤的主要成分是二氧化硅,二氧化硅的晶体类型是____________________。(单选)
a.金属晶体 b.离子晶体 c.原子晶体 d.分子晶体
(3)随着我国经济的快速发展,对电池新材料需求的不断增加,再加上手机、笔记本电脑、数码相机、摄像机、汽车等产品对新型、高效、环保电池材料的强劲需求,我国电池新材料市场将不断扩大。而铜锌原电池是一种最基本的将化学能转变为电能的装置,其中铜作________极,锌作_________极。
(4)塑料制品作为一种新型材料,具有质轻、防水、耐用、生产技术成熟、成本低的优点,在全世界被广泛应用且呈逐年增长趋势。乙烯通过加聚反应可以制成聚乙烯塑料,请写出聚乙烯的结构简式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示。

(1)步骤②、③、④中,均需进行的操作是_____________(填操作名称)。
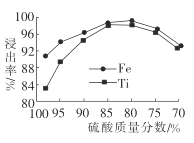
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为__________,硫酸质量分数对钛、铁浸出率的影响如图所示.据此判断,酸浸时所加硫酸的质量分数应为______(填范围)。.
(3)请结合离子方程式解释步骤④中加热水的原因:__________。
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在_______(填“阳极”或“阴极”)生成,____(填“能”或“不能”)将熔融CaO换成石灰乳。
(5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下:
![]()
①绿矾溶液中离子浓度由大到小的顺序为__________。
②FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+ )=1.0×10-5 mol·L-1。所得FeCO3中_____(填“含”或“不含”)有Fe(OH)2。已知: {Ksp[Fe(OH)2]= 4.9×10-17}
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com