
下列表示对应化学反应的离子方程式正确的是
A.稀硝酸中加入过量铁粉:Fe + 4H+ + NO=== Fe3+ + NO↑ + 2H2O
B.用铜作电极电解饱和食盐水:2Cl- + 2H2O  Cl2↑ + H2↑ + 2OH-
Cl2↑ + H2↑ + 2OH-
C.氯化铝溶液中加入过量氨水:Al3+ + 3NH3·H2O=== Al(OH)3 ↓+ 3NH
D.向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+===Ba2++CO2↑+H2O
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
现在四种晶体,其离子排列方式如图所示,其中化学式正确的是
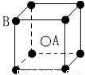



A.AB2 B.EF2 C.XY3Z D.AB3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:实验题
(14分)过氧化钙(CaO2)是一种白色粉末,微溶于水。加热至350°C左右开始分解,与水或酸能反应生成H2O2。应用于处理含重金属离子的废水,治理赤潮。其制备过程如下图所示

请回答下面的问题:
(1)CaO2的电子式___________
(2)制取CaO2·8H2O的原理是(用化学反应方程式表达): ,其中H2O2体现 性质。
(3)沉淀过程中加氨水的作用________________________________
(4)沉淀反应需用冰水浴控制温度,原因是_____________(写出两种)
(5)CaO2受热分解的化学方程式: 。
(6)CaO2质量百分百含量的测定:称取0.8000g样品用硫酸溶解,再用0.1000mol/L的KMnO4溶液滴定,消耗40.00 mLKMnO4溶液,则CaO2的含量为_________
(7)CaO2可以使废水中的Mn2+变成MnO2沉淀而除去,用离子方程式表达其原理 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
下列实验能达到实验目的的是
A.检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
B.向做完蔗糖水解后的溶液中直接加入新制的Cu(OH)2并加热,以检验蔗糖是否水解
C.将混有HCl的CO2通入饱和Na2CO3溶液中除去HCl
D.将Al2(SO4)3溶液蒸干制备Al2(SO4)3固体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:实验题
(15分)三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到。
已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解。实验室制取PCl3的装置示意图和有关数据如下:

物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
白磷 | 44.1 | 280.5 | 1.82 |
PCl3 | -112 | 75.5 | 1.574 |
POCl3 | 2 | 105.3 | 1.675 |
请回答:
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有 。制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥
的 (写出操作、现象、结论)。
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是 。
(3)E烧杯中加入冷水的目的是 ,干燥管中碱石灰的作用是 。
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有 (填字母序号)。
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是 (已知亚磷酸(H3PO3)是二元弱酸)。
②若将0.01 mol POCl3投入热水配成1 L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是 [已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:填空题
选考[化学—有机化学基础](13分)

(1)可鉴别风信子醛和突厥酮的试剂是 。
(2)下列关于风信子醛和突厥酮的说法中正确的是 (填序号)。
a.都属于芳香族化合物 b.都能使酸性高锰酸钾溶液褪色
c.突厥酮的分子式为C13H20O d风信子醛不能发生加成反应
(3)突厥酮与嗅水反应的化学方程式为 。
(4)芳香烃A发生如下反应生成F:

F与冬青油互为同分异构体。请回答:
①若A的分子式为C10 H14,则能实现上述转化的A的同分异构体有 种
②C→D的反应类型为 。
③设汁C→D和E→F步骤的目的为 。
④F生成高聚物的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高三质量检查理综化学试卷(解析版) 题型:选择题
第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010 mol·L-1的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是

A.气态氢化物的稳定性:Z>W>Y
B.简单离子半径:Z<W
C.Y元素存在同素异形体
D.X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市高三教学质量检查理综化学试卷 (解析版) 题型:推断题
【有机化学基础】(13分)某治疗有机磷农药中毒的选择性抗胆碱药合成的局部线路如下(部分反应条件略去):

根据要求回答下列问题:
(1)D分子中的含氧官能团为_________和_________(填名称)
(2)物质A不可能发生的反应类型有 ;
A.水解反应 B.加成反应 C.氧化反应 D.酯化反应
(3)已知: 合成线路中X(分子式为C8H6O3 )的结构简式为 ;
合成线路中X(分子式为C8H6O3 )的结构简式为 ;
(4)D发生聚合反应生成的高聚物的结构简式为 ;
(5)合成药物时,中间产物E的结构如图。E在一定条件下催化氧化,生成物能发生银镜反应。该反应的化学方程式为 。

(6)F与C互为同分异构体,且F分子具有如下特点:①含三个羟基;②含两个不直接相连的苯环,苯环上都是对位取代基;③核磁共振氢谱有5个峰且峰的面积比为2︰4︰4︰1︰1。
写出F的可能结构简式_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市等三校高二上学期期末化学试卷(解析版) 题型:选择题
根据下列实验现象,所得结论正确的是

实验 | 实验现象 | 结论 |
A | 左边烧杯中镁表面有气泡,右边烧杯中铜表面有气泡 | 还原性: Al>Mg>Cu |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 试管中白色固体先变淡黄色,后变为黄色 | 沉淀转化的实质就是沉淀溶解平衡的移动 |
D | 锥形瓶中有气体产生,烧杯中溶液变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com