
【题目】下列离子方程式书写正确的是 ( )
A.氢氧化铁胶体制备的化学方程式为:FeCl3+H2O![]() Fe(OH) 3 ↓+3HCl
Fe(OH) 3 ↓+3HCl
B.在硫酸氢钾溶液中加入Ba(OH)2溶液至过量:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.少量氯气通入溴化亚铁溶液中:Cl2+2Br- =Br2+2Cl-
D.向Fe(OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温下,0.1mol·L-1t溶液与0.1mol·L1u溶液的pH均为1。下列说法不正确的是( )
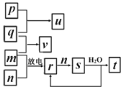
A.Y、W的最高价氧化物对应的水化物均为强酸
B.元素的非金属性:Z>Y>X,原子半径:X<Z<Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.v只有还原性,r既有还原性又有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带和海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
某化学兴趣小组将上述流程②、③设计成如下图所示操作。

已知过程②发生反应的化学方程式为Cl2+2KI===2KCl+I2
回答下列问题:
(1)写出提取过程①、③中实验操作的名称:①____________,③____________。
(2)在灼烧过程中,使用到的实验仪器有酒精灯、____________、____________(除泥三角外)。
(3)F中下层液体的颜色为________色,上层液体中溶质的主要成分为____________。
(4)从F中得到固态碘还需进行的操作是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一学生设计入图所示装置进行NaHCO3的分解,并证实产物中有CO2产生。
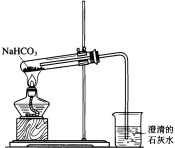
(1)试管中发生的化学反应方程式是____________________________。
(2)指出该学生设计的装置图的错误之处,并改正(文字说明即可)(至少2处)____________。
(3)烧杯中发生反应的离子方程式是_______________________________。
(4)如果将16.8gNaHCO3加热一段时间,然后将剩余固体溶于水,并加入足量的CaCl2溶液,最终得到白色沉淀5.0g,则NaHCO3分解百分率为______________,加CaCl2后反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2+O22SO3,其起始物质的量及SO2的平衡转化率如下表所示.下列判断中正确的是( )
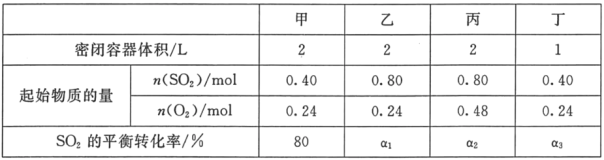
A.该温度下,该反应的平衡常数K为400
B.SO2的平衡转化率:a1>a2=a3
C.达到平衡时,容器丁中的正反应速率比容器丙中的大
D.达到平衡时,容器丙中c( SO3)大于容器甲中c( SO3)的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水体中部分含氮有机物循环如图1所示.
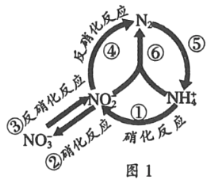
(1)图中属于氮的固定的是____ (填序号).
(2)图中①②的转化是在亚硝化细菌和硝化细菌作用下进行的,已知:
2NH4+(aq)+3O2═2NO2﹣(aq)+4H+(aq)+2H2O(l)△H1=﹣556.8kJ/mol
2NO2﹣(aq)+O2(g)=2NO3﹣(aq);△H2=﹣145.2kJmol﹣1
则反应NH4+(aq)+2O2(g)=NO3﹣(aq)+2H+(aq)+H2O(1)△H3=____kJmol﹣1
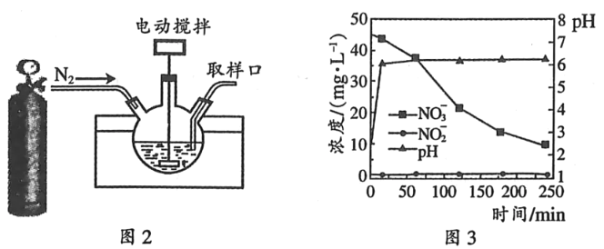
(3)某科研机构研究通过化学反硝化的方法除脱水体中过量的NO3﹣,他们在图示的三颈烧瓶中(装置如图2)中,加入NO3﹣起始浓度为45mgL﹣1的水样、自制的纳米铁粉,起始时pH=2.5,控制水浴温度为25℃、搅拌速率为500转/分,实验中每间隔一定时间从取样口检测水体中NO3﹣、NO2﹣及pH(NH4+、N2未检测)的相关数据(如图3).
①实验室可通过反应Fe(H2O)62++2BH4﹣=Fe↓+2H3BO3+7H2↑制备纳米铁粉,每生成1molFe转移电子总的物质的量为____.
②向三颈烧瓶中通入N2的目的是____.
③开始反应0~20min,pH快速升高到约6.2,原因之一是___________;NO3﹣还原为NH4+及少量在20~250min时,加入缓冲溶液维持pH6.2左右,NO3﹣主要还原为NH4+,Fe转化为Fe(OH)2,该反应的离子方程式为___
(4)一种可以降低水体中NO3﹣含量的方法是:在废水中加入食盐后用特殊电极进行电解反硝化脱除,原理可用图4简要说明.
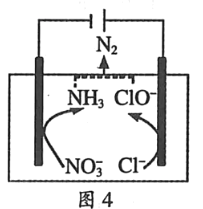
①电解时,阴极的电极反应式为_____.
②溶液中逸出N2的离子方程式为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应A(g)+B(g)![]() C(g),若反应物A的浓度从2 mol·L-1降到0.8 mol·L-1需20 s,则反应物A的浓度由0.8 mol·L-1降到0.2 mol·L-1所需的反应时间( )
C(g),若反应物A的浓度从2 mol·L-1降到0.8 mol·L-1需20 s,则反应物A的浓度由0.8 mol·L-1降到0.2 mol·L-1所需的反应时间( )
A. 等于10 sB. 大于10 sC. 小于10 sD. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取Fe、FeO、Fe2O3的均匀混合物质量为7.2g,向其中加入200 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出1120 mL(标准状况)的气体。所得溶液中,加入KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的此混合物,能产生铁的质量为 ( )
A. 1.4g B. 2.8g C. 5.6g D. 11.2g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com