
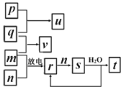
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温下,0.1mol·L-1t溶液与0.1mol·L1u溶液的pH均为1。下列说法不正确的是( )
A.Y、W的最高价氧化物对应的水化物均为强酸
B.元素的非金属性:Z>Y>X,原子半径:X<Z<Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.v只有还原性,r既有还原性又有氧化性
【答案】D
【解析】
v的水溶液呈碱性,则v为NH3;常温下,0.1mol·L-1t溶液与0.1mol·L1u溶液的pH均为1,则t溶液与u溶液都为强酸溶液;p和s均为有色气体,再由物质转化图,可确定p为Cl2,s为NO2;再据放电条件,可确定m、n为N2、O2。从而确定p、q、m、n分别是Cl2、H2、N2、O2,u为HCl,v为NH3,r为NO,s为NO2,t为HNO3。W、X、Y、Z分别为Cl、H、N、O。
A. N、Cl的最高价氧化物对应的水化物化学式为HNO3、HClO4,二者均为强酸,A正确;
B. 元素的非金属性O>N>H,原子半径H<O<N,两关系都正确,B正确;
C. NO2溶于水,发生反应3NO2+H2O==2HNO3+NO,氧化剂(NO2→NO)与还原剂(NO2→HNO3)的物质的量之比为1:2,C正确;
D. NH3、NO既有还原性又有氧化性,D错误。
故选D。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。下列说法不合理的是
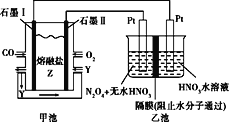
A.石墨Ⅰ是原电池的负极,发生氧化反应
B.甲池中的CO32-向石墨Ⅱ极移动
C.石墨Ⅰ的电极反应式:CO+CO32--2e-=2CO2
D.若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关容量瓶和分液漏斗的使用,正确的是( )

A.使用容量瓶前必须对其进行干燥
B.把混合液体转移至分液漏斗,塞上玻璃塞,如图所示用力振荡
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.定容后,盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸亚铁,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与![]() ,反应得富马酸亚铁。
,反应得富马酸亚铁。
已知:
物质名称 | 化学式 | 相对分子质量 | 电离常数(25℃) |
富马酸 |
| 116 |
|
碳酸 |
|
| |
富马酸亚铁 | FeC4H2O4 | 170 |
i.制备富马酸亚铁:
①将富马酸置于100mL烧杯A中,加热水搅拌
②加入![]() 溶液10mL使溶液pH为6.5-6.7。并将上述溶液移至100mL容器B中
溶液10mL使溶液pH为6.5-6.7。并将上述溶液移至100mL容器B中
③安装好回流装置C,加热至沸。然后通过恒压滴液漏斗D缓慢加入![]() 溶液30mL
溶液30mL
④维持反应温度100℃,充分搅拌1.5小时。冷却,减压过滤,用水洗涤沉淀
⑤最后水浴干燥,得棕红(或棕)色粉末,记录产量
请回答以下问题:
(1)该实验涉及到的主要仪器需从以上各项选择,则B为__________(填字母),C为___________(填名称)。
(2)已知反应容器中反应物![]() 和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入
和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入溶液调节pH的目的是______________________________________________;若加入
![]() 溶液过量,溶液pH偏高,则制得产品的纯度会_____________(填“偏高”“偏低”或“无影响”)。
溶液过量,溶液pH偏高,则制得产品的纯度会_____________(填“偏高”“偏低”或“无影响”)。
(3)配制![]() 溶液方法为称取
溶液方法为称取![]() 固体,溶于30mL新煮沸过的冷水中,需用新煮沸过的冷水的原因是____________________________________________________________________________。
固体,溶于30mL新煮沸过的冷水中,需用新煮沸过的冷水的原因是____________________________________________________________________________。
(4)步骤④中洗涤的目的主要是为了除去是___________离子,检验沉淀是否洗净的方法是:_____________。
ii.计算产品的产率:
(5)经测定,产品中富马酸亚铁的纯度为76.5%。以5.80g富马酸为原料反应制得产品8.10g,则富马酸亚铁的产率为_____________%。(保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用下图所示装置研究化学反应X+2Y=2Z的能量变化情况。向试管中滴加试剂Y时,看到U形管中液面甲下降,液面乙上升。下列关于该反应的叙述中正确的是( )
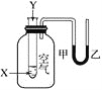
①该反应释放能量;②生成物的总能量比反应物的总能量高;③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来。
A. ①②③B. ①③C. ①②D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O。
(1)请分析该反应中电子转移的情况(用双线桥表示)。_____
(2)浓盐酸在反应中显示出来的性质是________(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,转移电子的物质的量为________mol。
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_
_______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数一定相同的是( )
A. 1 g H2和8 g O2
B. 0.1 mol HCl和2.24 L He
C. 150 ℃,1.01×105 Pa时,18 L H2O和18 L CO2
D. 常温常压下,28 g CO和6.02×1022个CO分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A.氢氧化铁胶体制备的化学方程式为:FeCl3+H2O![]() Fe(OH) 3 ↓+3HCl
Fe(OH) 3 ↓+3HCl
B.在硫酸氢钾溶液中加入Ba(OH)2溶液至过量:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.少量氯气通入溴化亚铁溶液中:Cl2+2Br- =Br2+2Cl-
D.向Fe(OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com