
【题目】下列实验目的能实现的是
A.实验室制备乙炔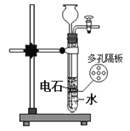 B.实验室制备氢氧化亚铁
B.实验室制备氢氧化亚铁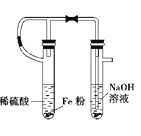 C.实验室制取氨气
C.实验室制取氨气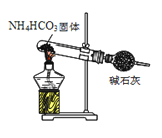 D.实验室制取乙酸丁酯
D.实验室制取乙酸丁酯
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入1mol N2和3molH2,一定条件下发生反应N2(g) + 3H2(g) ![]() 2NH3(g),达到化学平衡时,下列说法正确的是( )
2NH3(g),达到化学平衡时,下列说法正确的是( )
A.反应停止了B.正逆反应速率相等
C.N2的浓度为0D.H2的转化率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜别名一氯化铜为白色立方结晶或白色粉末,难溶于水,不溶于乙醇,在潮湿空气中易被迅速氧化。
Ⅰ.实验室用CuSO4-NaCl混合液与Na2SO3溶液反应制取CuCl。相关装置及数据如图。
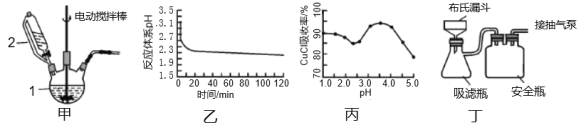
回答以下问题:
(1)甲图中仪器1的名称是___;制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,仪器2中所加试剂为___(填“A”或“B”)
A.CuSO4-NaCl混合液 B.Na2SO3溶液
(2)乙图是体系pH随时间变化关系图,写出制备CuCl的离子方程式___;丙图是产率随pH变化关系图,实验过程中往往用Na2SO3—Na2CO3混合溶液代替Na2SO3溶液,其中Na2CO3的作用是___,并维持pH在___左右以保证较高产率。
(3)反应完成后经抽滤、洗涤、干燥获得产品。抽滤所用装置如丁图所示,其中抽气泵的作用是使吸滤瓶与安全瓶中的压强减小,跟常规过滤相比,采用抽滤的优点是___(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是___。
Ⅱ.工业上常用CuCl作O2、CO的吸收剂,某同学利用如图所示装置模拟工业上测定高炉煤气中CO、CO2、N2、和O2的含量。
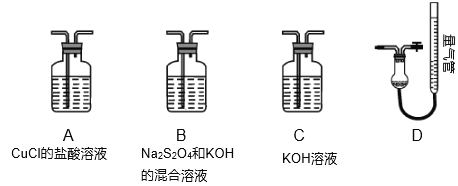
已知:Na2S2O4和KOH的混合液也能吸收氧气。
(4)装置的连接顺序应为___→D。
(5)用D装置测N2含量,读数时应注意___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里,常用如图所示装置制取并收集氨气。请回答下列问题:
(1)原理与方法
①制取氨气的化学方程式为__________________________________;
②该收集氨气的方法为________。
A.向上排空气法 B.向下排空气法
(2)装置与操作
按下图组装仪器,进行实验。仪器a的名称为____________。

(3)思考与交流
①欲制取标准状况下4.48 L NH3,至少需要NH4Cl________g;
②实验室制取氨气,还可采用下图中的______(填“A”或“B”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以CaO和HNO3为原料制备Ca(NO3)26H2O晶体。为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为
A.53.8%B.58.3%C.60.3%D.70.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组从有机废液中(主要含甲苯、二甲苯、苯酚)提取苯酚的流程图:

请填写下列空白:
(1)A的化学式是_______________。
(2)振荡的目的是_______________。
(3)分液操作需要的玻璃仪器有__________。
(4)写出水层中有关物质与A气体反应生成苯酚的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸在有机合成、医药化工、化纤等行业应用非常广泛。工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2![]() 4NO+6H2O ----①
4NO+6H2O ----①
4NO+3O2+2H2O→4HNO3----②
完成下列计算:
52、如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数是_________________(保留2位小数,下同)。
53、现以1.70吨液氨为原料生产硝酸,然后加入4.50吨水,得到密度为1.31g/cm3的硝酸,该硝酸的物质的量浓度是_______mol/L(假设生产过程中反应物和生成物均无损耗)。
54、把22.40 g铁完全溶解于某浓度的硝酸中,反应只收集到 0.30 mol NO2 和0.20 mol NO。通过计算推断反应后溶液中溶质的成分及其物质的量__________(写出计算过程)。
55、硝酸工业尾气中的NO、NO2属于大气的主要污染物。已知1m3硝酸工业的尾气中含3160mg NOx,其中n(NO) : n(NO2) = 9:1。
(1)如果用NaOH溶液完全吸收NOx,至少需要补充标准状况下的富氧空气多少升?
_________________________(富氧空气中O2的体积分数为0.25)(写出计算过程)
(2)如果用氨催化还原法,即用氨作催化剂,将NO、NO2转化为氮气直接排入空气中,需要氨气的质量为多少克?__________________________(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
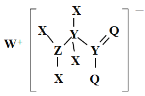
A.Z的最高价氧化物对应的水化物是一元强酸
B.WX的水溶液呈中性
C.元素非金属性的顺序为Y>Z>Q
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取水煤气反应C(s)+H2O(g)CO(g)+H2(g),化学平衡常数表示为K=![]() ,有关化学平衡常数说法正确的是( )
,有关化学平衡常数说法正确的是( )
A.由表达式可知c(CO)与c(CO)增大时,K值增大
B.其他条件不变时,温度升高,K值增大
C.化学平衡向右移动,K值增大
D.K值变化,化学平衡一定发生了移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com