
【题目】氯化亚铜别名一氯化铜为白色立方结晶或白色粉末,难溶于水,不溶于乙醇,在潮湿空气中易被迅速氧化。
Ⅰ.实验室用CuSO4-NaCl混合液与Na2SO3溶液反应制取CuCl。相关装置及数据如图。
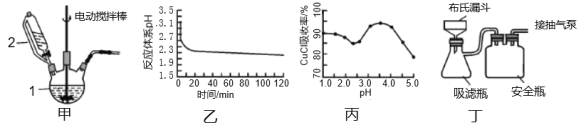
回答以下问题:
(1)甲图中仪器1的名称是___;制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,仪器2中所加试剂为___(填“A”或“B”)
A.CuSO4-NaCl混合液 B.Na2SO3溶液
(2)乙图是体系pH随时间变化关系图,写出制备CuCl的离子方程式___;丙图是产率随pH变化关系图,实验过程中往往用Na2SO3—Na2CO3混合溶液代替Na2SO3溶液,其中Na2CO3的作用是___,并维持pH在___左右以保证较高产率。
(3)反应完成后经抽滤、洗涤、干燥获得产品。抽滤所用装置如丁图所示,其中抽气泵的作用是使吸滤瓶与安全瓶中的压强减小,跟常规过滤相比,采用抽滤的优点是___(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是___。
Ⅱ.工业上常用CuCl作O2、CO的吸收剂,某同学利用如图所示装置模拟工业上测定高炉煤气中CO、CO2、N2、和O2的含量。
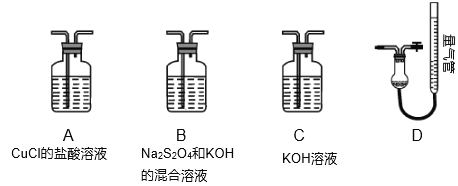
已知:Na2S2O4和KOH的混合液也能吸收氧气。
(4)装置的连接顺序应为___→D。
(5)用D装置测N2含量,读数时应注意___。
【答案】三颈烧瓶 B 2Cu2++SO32-+2Cl-+H2O=2CuCl↓+2H++SO42- 及时除去系统中反应生成的H+ 3.5 可加快过滤速度、得到较干燥的沉淀(写一条) 洗去晶体表面的杂质离子,同时防止CuCl被氧化 C→B→A 温度降到常温,上下调节量气管至左右液面相平,读数时视线与凹液面的最低处相切(任意两条)
【解析】
Ⅰ(1)根据仪器的结构和用途回答;仪器2中所加试剂应为Na2SO3溶液;
(2)乙图随反应的进行,pH 降低,酸性增强,Cu2+将SO32-氧化,制备CuCl的离子方程式2Cu2++SO32-+2Cl-+H2O=2CuCl↓+2H++SO42-;丙图是产率随pH变化关系图,pH =3.5时CuCl产率最高,实验过程中往往用CuSO4- Na2CO3混合溶液代替Na2SO3溶液,控制pH;
(3)抽滤的优点是可加快过滤速度、得到较干燥的沉淀;洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是洗去晶体表面的杂质离子,同时防止CuCl被氧化;
Ⅱ(4)氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故C中盛放氢氧化钠溶液吸收二氧化碳,B中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,A中盛放CuCl的盐酸溶液吸收CO,D测定氮气的体积,装置的连接顺序应为C→B→A→D;
(5)用D装置测N2含量,读数时应注意温度降到常温,上下调节量气管至左右液面相平,读数时视线与凹液面的最低处相切。
Ⅰ(1)根据仪器的结构和用途,甲图中仪器1的名称是三颈烧瓶;制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,仪器2中所加试剂应为Na2SO3溶液,便于通过分液漏斗控制滴加的速率,故答案为:三颈烧瓶;B;
(2)乙图是体系pH随时间变化关系图,随反应的进行,pH 降低,酸性增强,Cu2+将SO32-氧化,制备CuCl的离子方程式2Cu2++SO32-+2Cl-+H2O=2CuCl↓+2H++SO42-;丙图是产率随pH变化关系图,pH =3.5时CuCl产率最高,实验过程中往往用CuSO4- Na2CO3混合溶液代替Na2SO3溶液,其中Na2CO3的作用是及时除去系统中反应生成的H+ ,并维持pH在3.5左右以保证较高产率,故答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+2H++SO42-;及时除去系统中反应生成的H+;3.5;
(3)抽滤所采用装置如丁图所示,其中抽气泵的作用是使吸滤瓶与安全瓶中的压强减小,跟常规过滤相比,采用抽滤的优点是可加快过滤速度、得到较干燥的沉淀(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是洗去晶体表面的杂质离子,同时防止CuCl被氧化,故答案为:可加快过滤速度、得到较干燥的沉淀(写一条);洗去晶体表面的杂质离子,同时防止CuCl被氧化;
Ⅱ(4)氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故C中盛放氢氧化钠溶液吸收二氧化碳,B中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,A中盛放CuCl的盐酸溶液吸收CO,D测定氮气的体积,装置的连接顺序应为C→B→A→D,故答案为:C→B→A;
(5)用D装置测N2含量,读数时应注意温度降到常温,上下调节量气管至左右液面相平,读数时视线与凹液面的最低处相切(任意两条),故答案为:温度降到常温,上下调节量气管至左右液面相平,读数时视线与凹液面的最低处相切(任意两条)。


科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列的物理量不再发生变化时,表明反应A(固)+2B(气)![]() C(气)+D(气)已达到平衡状态的是( )
C(气)+D(气)已达到平衡状态的是( )
A. 混合气体的压强 B. 混合气体的密度
C. 气体的总物质的量 D. A的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组根据反应:H2O2+2HI=2H2O+I2探究影响化学反应速率的因素。实验数据如下:
实验 编号 | H2O2溶液浓度/(mol·L-1) | HI溶液浓度/(mol·L-1) | 温度/℃ | 反应速率/(mol·L-1·s-1) |
① | 0.1 | 0.1 | 25 | 0.0076 |
② | 0.1 | 0.2 | 25 | 0.0153 |
③ | 0.1 | 0.3 | 25 | 0.0227 |
④ | 0.1 | 0.1 | 35 | 0.0304 |
回答下列问题:
(1)反应:H2O2+2HI=2H2O+I2中,氧化剂是___。
(2)25℃时,表明增大反应物浓度,化学反应速率___(填“增大”或“减小”)。
(3)能表明温度对化学反应速率影响的实验编号是①和___。
(4)H2O2不稳定,写出H2O2发生分解反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
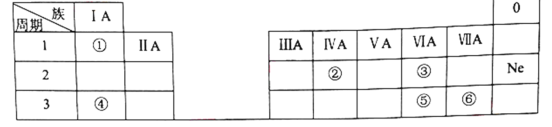
(1)②的元素符号是______。
(2)⑤和⑥两种元素的非金属性强弱关系是:⑤______⑥。
(3)①和③两种元素组成的化合物中含有的化学键为________(填“离子键”或“共价键”)。
(4)④和⑥两种元素组成的化合物与AgNO3溶液反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素,请根据要求回答问题:
| IA | 0 | |||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | Ar | ||||
(1)②的元素符号是_______
(2)①、⑤两种元素的原子半径大小关系:①__⑤(填“>”或“<”);
(3)③、④和⑤中,金属性最强的元素是____(填元素符号);
(4)⑤、⑥的最高价氧化物对应的水化物相互反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氢氧燃料电池装置示意图,下列有关说法正确的是( )
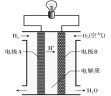
A. 电极A为正极
B. 产物为水,属于环境友好电池
C. 电子流向:电极B→导线→电极A
D. 该电池的化学能可以100%转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基础化工原料,在一定条件下可发生下列转化:
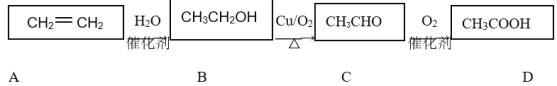
请根据题意填空:
(1)CH3COOH的官能团为________(填“羟基”或“羧基”);
(2)既能使溴水褪色,又能使酸性高锰酸钾溶液褪色的是________(填“A”或“B”);
(3)完成B→C的化学方程式:2CH3CH2OH+O2![]() 2CH3CHO+__________。
2CH3CHO+__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y具有抗菌、消炎作用,可由X制得。
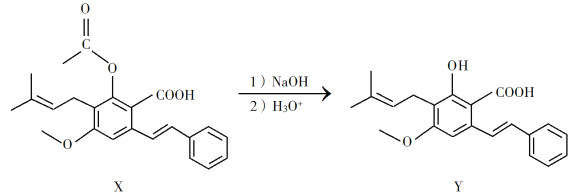
下列有关化合物X、Y的说法正确的是
A. 1 mol X最多能与2 mol NaOH反应
B. Y与乙醇发生酯化反应可得到X
C. X、Y均能与酸性KMnO4溶液反应
D. 室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数目相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com