
【题目】乙烯是一种重要的基础化工原料,在一定条件下可发生下列转化:
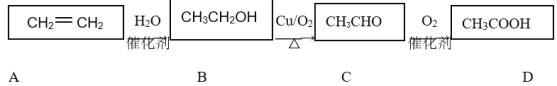
请根据题意填空:
(1)CH3COOH的官能团为________(填“羟基”或“羧基”);
(2)既能使溴水褪色,又能使酸性高锰酸钾溶液褪色的是________(填“A”或“B”);
(3)完成B→C的化学方程式:2CH3CH2OH+O2![]() 2CH3CHO+__________。
2CH3CHO+__________。
【答案】羧基 A 2H2O
【解析】
由转化关系可知,不饱和烃乙烯一定条件下和水发生加成生成乙醇,乙醇在铜作催化剂作用下,和氧气共热发生氧化反应生成乙醛,乙醛在催化剂作用下,和氧气共热发生氧化反应生成乙酸。
(1)CH3COOH的官能团为羧基,故答案为:羧基;
(2)乙烯属于不饱和烃,分子中含有碳碳双键,既能与溴水发生加成反应使溴水褪色,又能与酸性高锰酸钾溶液发生氧化反应使酸性高锰酸钾溶液褪色,乙醇能与酸性高锰酸钾溶液发生氧化反应使酸性高锰酸钾溶液褪色,但不能使溴水褪色,故答案为:A;
(3)B→C的反应为乙醇在铜作催化剂作用下,和氧气共热发生氧化反应生成乙醛,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,故答案为:2H2O。
2CH3CHO+2H2O,故答案为:2H2O。


科目:高中化学 来源: 题型:
【题目】(1)将a mol Cl2 通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,写出另2个可能发生的离子方程式。
①当 a / b =1时___;②当a / b≥3/2时_______。
(2)观察反应①②,总结规律,并模仿反应①②方程式完成下列问题:①Al(OH)3 +H2O![]() Al(OH)4― + H+;②NH3+H2O
Al(OH)4― + H+;②NH3+H2O![]() NH4+ + OH―。
NH4+ + OH―。
(A)已知B(OH)3是一元弱酸,试写出其电离方程式: ___;
(B)N2H4是二元弱碱,其电离分步进行,第一步电离方程式N2H4+H2O![]() N2H5+ + OH―,试写出其第二步电离方程式_____。
N2H5+ + OH―,试写出其第二步电离方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,2018年是合成氨工业先驱哈伯(P·Haber)获得诺贝尔奖100周年
(1)合成氨反应是一个可逆反应:N2(g)+3H2(g)![]() 2NH3(g),已知298K时:ΔH=-92.2kJ/mol,ΔS=-198.2J/(K·mol),则根据正反应的焓变和熵变分析,常温下合成氨反应____(填“能”或“不能”)自发进行。实验研究表明,在特定条件下,合成氨反应的速率与参加反应的物质的浓度的关系式如下,v=kc(N2)c1.5(H2)c-1(NH3),k为速率常数,请根据该关系式分析,如果想增大合成氨反应的速率,从浓度的角度可以采用的措施为________。根据合成氨反应的特点,请再说出一项能够提高合成氨反应速率的措施_________。
2NH3(g),已知298K时:ΔH=-92.2kJ/mol,ΔS=-198.2J/(K·mol),则根据正反应的焓变和熵变分析,常温下合成氨反应____(填“能”或“不能”)自发进行。实验研究表明,在特定条件下,合成氨反应的速率与参加反应的物质的浓度的关系式如下,v=kc(N2)c1.5(H2)c-1(NH3),k为速率常数,请根据该关系式分析,如果想增大合成氨反应的速率,从浓度的角度可以采用的措施为________。根据合成氨反应的特点,请再说出一项能够提高合成氨反应速率的措施_________。
(2)研究表明,在Fe催化剂作用下合成氨的反应历程为(*表示吸附态):
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+H*![]() NH*;NH*+H*
NH*;NH*+H*![]() NH2*;NH2*+H*
NH2*;NH2*+H*![]() NH3*
NH3*
脱 附:NH3*![]() NH3(g)
NH3(g)
其中,N2的吸附分解反应速率慢,解决了合成氨的整体反应速率。
实际生产中,合成氨常用工艺条件:Fe作催化剂,控制温度773K,压强3.0×107Pa,原料中N2和H2物质的量之比为1:2.8。请回答:
①分析说明原料中N2过量的理由____________。
②近年来,中国科学院大连化学物理研究所陈平研究团队经过近二十年的积累,先后在催化剂分解、催化氨合成、化学链合成氨等方面取得重要进展。关于合成氨工艺的下列理解,正确的是______。
A.人们对合成氨研究的重要目的之一是要实现氨的低温高效合成
B.控制温度(773K)远于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.陈平团队首次报道了具有优异低温活性的LiH-3d过渡金属这一复合催化剂体系,它可以大大提高反应的平衡转化率
D.N2的吸附分解反应活化能高,是合成氨反应条件苛刻的重要原因
E.陈平团队构建了一条基于可再生能源的化学链合成氨工艺流程,可以显著提高能效
(3)若N2和H2生成NH3的反应为:![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g),的标准平衡常数
NH3(g),的标准平衡常数 ,其中
,其中![]() 为标准大气压(1×105Pa),
为标准大气压(1×105Pa),![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如P(NH3)=x(NH3) P,P为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。
为各组分的平衡分压,如P(NH3)=x(NH3) P,P为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为![]() ,则
,则![]() _________(用含
_________(用含![]() 的最简式表示)
的最简式表示)
②根据合成氨反应的特点,标准平衡常数![]() 随温度T升高而逐渐______(填“增大”或“减小”)。
随温度T升高而逐渐______(填“增大”或“减小”)。
(4)希腊两位科学家曾经采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶体薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。钯电极A为______极(填“阴”或“阳”),该极上的电极反应式是___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
B. Na2O2与CO2反应生成0.1 mol O2时转移电子0.4 mol
C. Na2O2投入到CuCl2溶液中有蓝色沉淀及气泡产生
D. 向饱和烧碱溶液中加入2 g Na2O2,充分反应完后,溶液中c(Na+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实用性很强的科学。根据题意填空:
(1)古代锻造刀剑时,将炽热的刀剑快速投入水中“淬火”,反应为:3Fe+4H2O(g) ![]() Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
(2)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有________(填“钠”或“钾”)元素;
(3)海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。该沉淀剂是__________(填“生石灰”或“盐酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O氧化剂是______,氧化产物与还原产物的物质的量之比为_______。
(2)配平下列反应方程式
①____S +____HNO3——_____H2SO4 +______NO2↑ +____H2O
② 若6.4g单质硫参加反应时,反应过程中转移电子的物质的量为______。
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为_____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0的化学反应下列叙述不正确的是
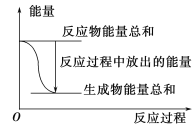
A. 反应过程中能量关系可用上图表示
B. ΔH的值与反应方程式的计量系数有关
C. 若将该反应设计成原电池,锌为负极
D. 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成n mol NO的同时,消耗n mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v逆(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Ca2+、AlO2-、SiO32-、CO32-、SO42-中的若干种离子.某同学对该溶有进行了如下实验下列判断正确的是( )

A.K+、AlO2-、SiO32-和CO32-一定存在于溶液X中
B.沉淀甲是硅酸和硅酸钙的混合物
C.气体甲一定是纯净物
D.SO42-一定不存在于溶液X中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com